
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Капелько В.И. Внеклеточный матрикс миокарда и его изменения при заболеваниях сердца. Кардиология (2000), №9, С.78-92
|
|
|
|
МЕЖКЛЕТОЧНЫЙ МАТРИКС МИОКАРДА
Потенциал покоя сарколеммы ≈90-100 мэВ, его меняет работа Na/K-АТФазы. Каждая миофибрилла на уровне Z -линии окружена каналами Т-системы (радиальные впячивания в саркоплазму сарколеммы в виде трубочек), которая обеспечивает передачу возбуждения от сарколеммы к элементам СПР и позволяет одновременно сокращаться всем участкам мышечного волокна. Трубочки соседних саркомеров сообщаются между собой, но не связаны с полостями СПР. Система СПР делит саркоплазму на отдельные отсеки. Концевые цистерны СПР охватывают миофибриллы также по обе стороны от Z -линии, от этих цистерн к диску А отходят трубочки, сливаясь посередине диска А в цистерну, через которую проходят толстые нити миозина. Прилегающие к миофибриллам мембраны СПР содержат Са-связывающие белки, которые при движении мышц освобождают и убирают Са2+, синтезирует белки липиды, гликоген. Саркоплазма мышечного волокна – коллоидная белковая структура с вкраплениями глыбок гликогена и жировых капель, в ней много митохондрий, которые располагаются цепочками вдоль миофибрилл.
Мышечные белки.
2 группы: саркоплазматические и миофибриллярные.
· Саркоплазматические белки экстрагируются из мышц солевыми растворами с малой ионной силой. Это миоглобин, способный связывать кислород, ферменты гликолиза и митохондрий, белки, участвующие в обмене Са, – кальсеквестрин и белок «с высоким сродством к кальцию».
· Миофибриллярные белки экстрагируются из мышц солевыми растворами с высокой ионной силой. Эти белки составляют основу молекулярной структуры миофибрилл.
Поперечная исчерченность миофибрилл скелетных мышц связана с чередованием и взаимным расположением различных по толщине молекул основных белков миозина и актина (см. учебники по физиологии, гистологии). Миозин в мышечном волокне образует толстые миозиновые филаменты (А-диск) – это пучки из сотен молекул миозина, расположенных параллельно. Актин в мышечных фибриллах является основным белком тонких филаментов (I диск), дополнительными – тропомиозин и тропонин.
Особенность синтеза миозина и актина. На стадии посттрансляционной модификации этих белков происходит метилирование остатков гистидина. При расщеплении этих белков образуется 3-метилгистидин, который далее не разрушается. Количество метилгистидина в моче служит мерой деградации мышечных белков. В составе миозина также метилируется лизин по атому азота в боковом радикале с образованием N-метиллизина.
Миозин миофибрилл ~65% мышечного белка, молекулярная масса ~500 кД. Молекула миозина сильно вытянутой формы, разделяется без разрыва ковалентных связей на 6 субъединиц:
· 2 идентичные тяжелые цепи (по 223 кДа или 205-210 кДа) и
· 4 короткие легкие цепи (~20 кДа), связанные нековалентно.
Количество легких цепей в молекуле миозина в разных типах
мышц и у различных видов животных неодинаково.
Миозин имеет форму стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа).
"Хвост" молекулы в миозине образуют С-концевые α-спиральные участки тяжелых цепей, закрученные в длинную двойную суперспираль. К глобулярному N-концу каждой тяжелой цепи нековалентно присоединены 2 лёгкие цепи, создающие "головку" молекулы, способную соединяться с актином. Головки миозина присоединены к остальной части молекулы гибким участком и выдаются наружу из основного стержня. Это позволяет головке обратимо присоединяться к актину. В головке миозина также есть центры связывания с АТФ. Головка обладает Са2+-зависимой АТФ-азной актив ностью (способна гидролизовать АТФ на АДФ + Фн), которая регулируется малыми субъединицами. Палочкообразные хвосты молекул миозина могут соединяться друг с другом, образуя пучки. Головки располагаются вокруг пучка по спирали. В области М-линии пучки соединяются «хвост к хвосту», образуя миозиновые нити саркомера.
Актин – главный белок тонких нитей, ~20-25% мышечного белка, (ММ ~ 42кD или 70кD). Существует в 2 формах. Глобулярная форма – мономеры G-актина, которые содержат молекулу АТФ и ион Са2+. G-актин полимеризуется в нити F-актина, образуя фибриллярную форму. Молекулы F-актина – линейные полимеры, свёрнутые в двуцепочечную сверхспираль из мономеров G-актина с шагом спирали 36,5 нм (напоминают две нити бус, скрученных относительно друг друга по продольной оси). При полимеризации G-актина в F-актин затрачивается АТФ, переходу способствуют ионы (К+, Mg2+). Фибриллярный F-актин находится в равновесии с глобулярным G-актином, является важным структурным элементом цитоскелета клетки, имеет центры связывания с миозином. F-актин легко образует с миозином комплекс – актомиозин.
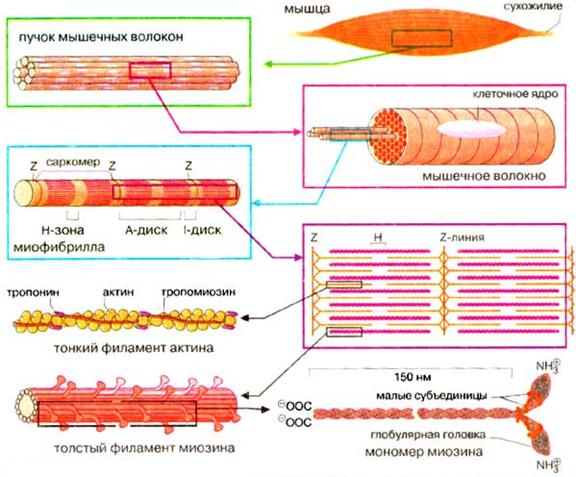
РИС. Организация скелетных мышц
Кроме актина к белкам тонких нитей относят тропомиозин и тропонин. Актин, тропомиозин и тропонин связаны между собой нековалентными связями.
Тропомиозин – двухцепочечная α-спирализованная палочковидная молекула (ММ 64 – 70 кD), располагается в желобке между цепями F-актина. Длина молекулы тропомиозина равна 7 субъединицам G-актина в составе F-актина. В покое тропомиозин закрывает в актине центры связывания с миозином.
Тропонин (ММ 76 – 78 кD) – комплекс из 3-х глобулярных субъединиц (Т, С, I), расположен на концах каждой молекулы тропомиозина, связывается как с актином, так и с тропомиозином. Субъединица Т обеспечивает связь с тропомиозином, субъединица С образует связь с Са2+, субъединица I ингибиторная и в покое мешает взаимодействию актина с миозином.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 733; Нарушение авторских прав?; Мы поможем в написании вашей работы!