
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчини кислот
|
|
|
|
1) Сильні кислоти повністю дисоціюють у розведених розчинах. Тому можна прийняти, що
[ H+ ] =Cкисл.
рН= -lg Cкисл.
Так, для 0,03н розчинуHCl знаходимо
pН =  .
.
2) Слабкі кислоти
Для кислоти складу НА константа дисоціації дорівнює
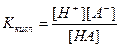 , але
, але
Cкисл =[ HА ] і [ H+ ]= [ А- ], тому


Зручно користовуватися величиною рКкисл = -lg Ккисл

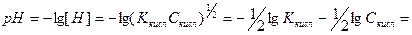
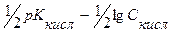
Приклад: 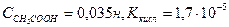
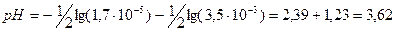
3) Багатоосновні кислоти
Розглядаємо константи ступінчатої дисоціації, наприклад, вугільної (карбонатної) кислоти:

 Н2СО3 Н++ НСО3-
Н2СО3 Н++ НСО3-

 НСО3- Н++ СО32-
НСО3- Н++ СО32-
 (рК1=6,5)
(рК1=6,5)
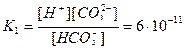 (рК2=10,2)
(рК2=10,2)
Отже, друга константа дисоціації в 5000 раз менша першої, тому друга ступінь дисоціації не має практичного впливу на величину рН розчину слабкої кислоти. Крім того, слід мати на увазі, що концетрація  дуже мала. Тому, наприклад, для 0,01н розчину карбонатної кислоти знаходимо
дуже мала. Тому, наприклад, для 0,01н розчину карбонатної кислоти знаходимо

|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 315; Нарушение авторских прав?; Мы поможем в написании вашей работы!