
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчини солей
Вивід формул, для розрахунку рН розчинів солей є досить складною і довготривалою справою. Тому наводимо кінцеві формули для деяких видів.
1) Солі слабких кислот і сильних основ


Приклад: обчислити рН 0,1м розчину оцтовокислого натрію.

2) Аналогічно обчислюється рН розчинів солі утворених сильними кислотами і слабкими основами
3) Середні солі багатоосновних кислот
Формула подібна до попередньої, однак, слід пам’ятати, що треба підставляти константи дисоціації останнього ступення дисоціації.
Приклад: обчислити рН 0,5м розчину Na3PO4
Із довідника вибираємо для ортофосфорної кислоти рК1=2.1, рК2=7.2, рК3=12.3 і користуємось останньою величиною.

4) Кислі солі
Концентрація водневих іонів в розчині кислої солі залежить від обох констант дисоціації двохосновної кислоти і мало залежить (в певних межах) від Cкисл. Тому формула має вигляд

Приклади:
а) обчислити рН 0,5м розчину гідрокарбонату натрію.
З таблиць знаходимо для Н2СО3 рК1= 6.5 і рК2=10.2
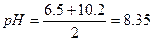 (реакція розчину лужна)
(реакція розчину лужна)
б) обчислити рН 0,5м розчину гідросульфату натрію
З таблиць знаходимо для Н2SО3 рК1=1.8 і рК2=7.2
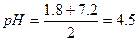 (реакція розчину кисла)
(реакція розчину кисла)
5. Буферні розчини (буферні суміші).
У різних галузях хімії і технології велике значення мають буферні суміші. Здебільшого вони уявляють собою суміш розчинів слабких кислот з розчинами солей слабких кислот або слбких основ з їх солями.
Для кількісного аналізу вони уявляють інтерес тому, що при титруванні слабких кислот (основ) та їх солей в процесі нейтралізації утворюється розчин, який містить частину солі цієї кислоти (основи) та залишок вільної кислоти (основи).
Буферні розчини використовуються також для визначення рН (наприклад, градуювання рН-метрів), а також у якості середовища з постійним значенням рН при експерементальній розробці проблем хімії, біохіії тощо.
Для розрахунку рН буферного розчину скористаємось виразом константи дисоціації вільної слабкої кислоти
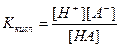
Проте у присутності соллі КА різко збільшується [А-]. Можно прийняти що
[А-]= Cсолі [НА]= Cкисл.
Отже:


-lg[ H+ ]=- - lg Cкисл - lg Kкисл. + lg Cсoлi..
Тобто

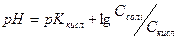
З формули видно, що рН буферних розчинів не залежить від абсолютних концентрацій солі і кислоти, а залежить тільки від їх співвідношення.
Тому рН буферного розчину не змінюєьбся при його розведенні. Якщо прилити буферну суміш до якогось розчину, який не містить власних власних кількостей інщих кислот, основ або сильногідралізованих солей, рН цього розчину буде відповідати рН буферної суміші.
Приклад: обчислити рН суміші 0.03н оцтової кислоти і 0.1н розчину ацетату натрію. Для СН3СООН рК=4.8

Якщо розвести розчин в 10 раз, то рН розчину не зміниться, що видно з розрахунку
 .
.
|
Дата добавления: 2014-01-04; Просмотров: 689; Нарушение авторских прав?; Мы поможем в написании вашей работы!