
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості
|
|
|
|
Фізичні властивості.
Всі дикарбонові кислоти – тверді речовини, розчинні у воді. Зі збільшенням молекулярної маси розчинність їх у воді зменшується. Фумарова і малеїнова кислота різко відрізняються і по фізичним і по хімічним властивостям. Тпл фумарової кислоти 2880С, а малеїнової – 1300С, фумарова погано розчинна у воді, а малеїнова – дуже гарно.
Ароматичні фталеві кислоти погано розчинні у воді, особливо терефталева.
У водних розчинах двохосновної кислоти підлягають східцевій дисоціації.
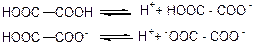
Здібність до дисоціації у двохосновних кислот більше, ніж у відповідних по кількості атомів вуглецю одноосновних кислот. Так щавлева кислота більше сильніша кислота (Кд = 3,8·10-2), ніж одноосновна оцтова (Кд=1,76·10-5). Це пояснюється взаємним впливом карбоксильних груп, полегшуючим дисоціацію.
Сила двохосновних кислот залежить від взаємного розміщення карбоксильних груп в вуглецевому ланцюжку: чим вони більш віддалені один від одного, тим кислота слабша. Тому щавлева кислота є найбільш сильнішою двохосновною кислотою.
Для дикарбонових кислот властиві ті ж хімічні властивості, що і для монокарбонових кислот. Різниця у тому, що у реакціях можуть приймати участь як одна, так і дві карбоксильні групи. Тому дикарбонові кислоти долають два ряди солей і два ряди функцій них похідних кислот: повні і неповні галогенангідріди, складні ефіри, аміди. Наприклад: НООС-СООNа – кислий щавлевокислий Nа (кисла сіль), NаООС-СООNа – щавлевокислий Nа (середня сіль).
Так же ведуть себе двохосновні кислоти з двома і трьома вуглецевими атомами. Вони не утворюють циклічних ангідридів, а при t0 розкладаються, виділяючи СО2 й перетворюються на одноосновні кислоти:
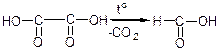

щавлева мурашина малонова оцтова
Розклад карбонових кислот з виділенням СО2 називається реакцією декарбоксилування.
Здібність янтарної і глутарової кислот і нездібність щавлевої і малонової кислот давати циклічні ангідриди легко пояснюється. Валентний кут між атомами вуглецю рівняється 1090 28', тому вуглецевий ланцюжок з 4 і 5 атомів може бути зігнутим, тому що кінці молекул близько підходять один до одного, і якщо на кінцях знаходяться дві карбоксильні групи, то при такому близькому раз положенні вони відщеплюють воду, замикають цикл. При цьому утворюються стійкі п’яти- або шестичленні цикли. А молекули з двох і трьох атомів вуглецю не можуть так зігнутися, щоб дві карбоксильні групи опинилися близько одна біля одної.
У малонової кислоти водневі атоми СН2-групи дуже рухомі. Із-за впливу двох карбоксильних груп. З участю цих рухомих атомів водню молонова кислота вступає у різні реакції заміщення. Наприклад:
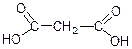
в ефірах малонової кислоти атоми водню здібні заміщуватися атомами лужних металів. Наприклад: із діетилового ефіру малонової кислоти при дії натрію або алкоголяту натрію легко утворюється натріймалоновий ефір:
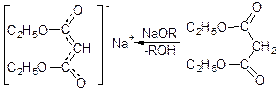
Наріймалонового ефіру негативний заряд крапки між атомами вуглецю і двома атомами кисню, дякуючи чому він стійкий і легко утворюється з малонового ефіру. Ця особливість малонового ефіру широко використовується у лабораторній практиці для синтезу органічних сполук.
Фумарова і малеїнова кислоти, як двохосновні кислоти, утворюють кислі і середні солі, повні і неповні ефіри і аміди. Але у них є і відзнаки в хімічних властивостях. Так малеїнова кислота легко виділяє воду, дає циклічний ангідрид:

малеїновий ангідрид
Це пояснюється тим, що у малеїнової кислоти карбонільні групи знаходяться з однієї сторони подвійного зв’язку, тому вони зближені у просторі і можлива їх взаємодія. У фумарової кислоти карбонільні групи знаходяться по різні боки від подвійного зв’язку і настільки відділені один від одного, що їх взаємодія неможлива, тому фумарова кислота ангідридів не утворює.
Аналогічно утворює ангідрид і 0-фталева кислота:
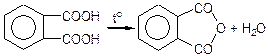
фталевий ангідрид
м-фталева і п-фталева кислоти не утворюють внутрішньомолекулярних ангідридів.
Терефталева кислота широко використовується для виробництва поліефірних волокон, зокрема для виробництва лавсана (поліетилентерефталата):
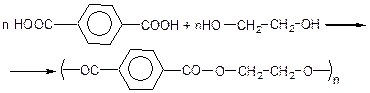
Література
1. Степаненко Б.Н. Курс органической химии. (в 2-х частях), ч. 2. Карбоциклические и гетероциклические соединения. Учеб. для вузов. 6-е перер. и доп. М.: Высшая школа. 1981.
2. Тейлор Г. Основы органической химии для студентов нехимических специальностей./ пер. с англ. Е.Д./ М.: Мир. 1989.
3. Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия. В 3-х томах. Харьков: Основа. 1993, 1995, 1998.
4. Домбровський А.В. Органічна хімія. Навч. посіб. – К.: Вища школа. 1991
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2142; Нарушение авторских прав?; Мы поможем в написании вашей работы!