
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Криві титрування
|
|
|
|
План
Криві титрування та індикатори редоксометрії.
Криві титрування та індикатори редоксометрії.
1. Криві титрування.
2. Індикатори редоксометрії
Зміна концентрації компонентів, що реагують, і залежна від неї зміна потенціалу в процесі окисно-відновного титрування може бути вивчена експериментально, а в ряді випадків розрахована на основі формули Нерста.
При експериментальному визначенні у розчин, що піддається титруванню, занурюють платиновий електрод і з’єднують через сольовий місток з нормальним водневим електродом. За допомогою бюретки вимірюють об’єм титранта, а користуючись включеним у водневий місток потенціометром — окисно-відновний потенціал системи Ех. Побудована на основі цих даних графічна залежність і є кривою титрування даного методу оксидиметрії.
Розрахунковий спосіб побудови кривих титрування пояснимо на прикладі титрування заліза (ІІ) ванадатом. Схематично цей процес виглядає так:
Fe+2 +V+5 = Fe+3 +V+4
Значення відповідних нормальних редокспотенціалів таке:
 = 0,77 В
= 0,77 В 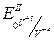 = 1,20 В
= 1,20 В
На самому початку титрування у розчині висока концентрація Fe+2 тому потенціал системи буде низький (таблиця). Згідно з формулою Нернста,
 = 0,77 + 0,06×
= 0,77 + 0,06×
при збільшені [ Fe+2 ], потенціал буде поступово підвищуватись (позиції 2-6 таблиці). Поблизу точки еквівалентності (7), як і при кислотно-основному титруванні, зміна концентрації стає більш різкою оскільки приливання невеликої кількості V+5 призводить до окиснення залишку Fe+2 і різкого зростання співвідношення [ Fe+3 ]/[ Fe+2 ]. Після точки еквівалентності потенціал продовжує змінюватись спочатку більш різко (позиція 8), потім все менше (9, 10). Це пов’язано з тим, що спочатку з’являється помітний надлишок V+5, тому на невеликому діапазоні збільшення об’єму титранта збільшується співвідношення [ V+5 ]/[ V+4 ], що призводить до збільшення потенціалу
 =
= 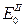 + 0,06×
+ 0,06×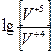 .
.
При подальшому додаванні надлишку розчину V+5 потенціал вже не росте так швидко.
Побудований на основі даних таблиці зразок кривої титрування редоксометрії наведена на рисунку. Вона характеризується помітним стрибком редокс-потенціалу системи. Це дозволяє, по-перше, зробити висновок про можливості практичного застосування цього методу, по-друге, вибрати придатний для його здійснення індикатор.
Таблиця1
Титрування 100 мл 0,1н р-ну FeSO4 в 10н H2SO4 розчином NH4VO3
| № позиції | Додано 0,1н р-ну NH4VO3, мл | Відношення концентрації іонів, що визначають потенціал системи | Потенціал
 = = 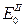 + 0,06× + 0,06×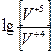 , В , В
|
| 1* | 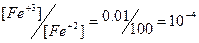
| 0,77 + 0,06×lg10-4 = 0,53 | |
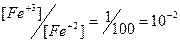
| 0,77 + 0,06×lg10-2 = 0,65 | ||
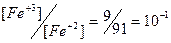
| 0,77 + 0,06×lg10-1 = 0,71 | ||
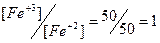
| 0,77 + 0,06×lg1 = 0,577 | ||
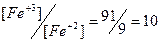
| 0,77 + 0,06×lg10 = 0,83 | ||
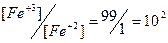
| 0,77 + 0,06×lg102 = 0,89 | ||
| 7** | 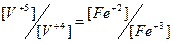
| 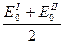 = = 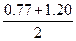 = =
| |
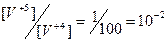
| 1,20 + 0,06×lg10-2 = 1,08 | ||
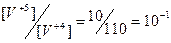
| 1,20 + 0,06×lg10-1 = 1,14 | ||
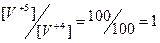
| 1,20 + 0,06×lg1 = 1,20 |
*На початку титрування умовно прийнято, що в розчині солі заліза (ІІ) міститься 0,01% заліза (ІІІ).
**Точка еквівалентності.
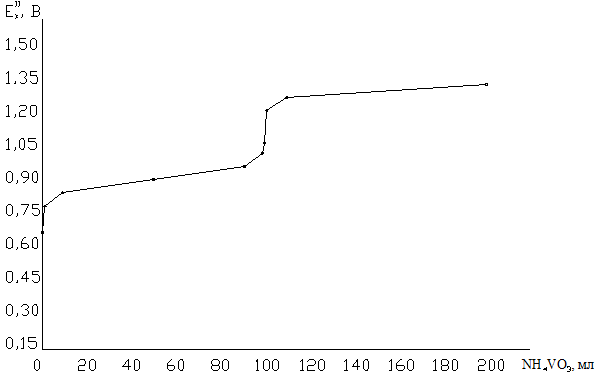
Рисунок 1 Криві титрування FeSO4 в 10н H2SO4 розчином NH4VO3.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 989; Нарушение авторских прав?; Мы поможем в написании вашей работы!