
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод колориметричного титрування
|
|
|
|
Суть методу.
2. Метод стандартних серій.
4. Прилади колориметричного методу аналізу.
Колориметричні методи застосовуються для визначення вмісту малих кількостей різних речовин (1∙10-4 — 1∙10-5 г в об'ємі 50-100 мл), які не можна визначити ваговим та об’ємним методами. Застосовується колориметричний аналіз також і для визначення порівняно великого вмісту речовин.
В основі колориметричного метода аналізу лежать реакції утворення або руйнування забарвлених сполук, тобто сполук, які здатні поглинати світло. При утворенні забарвленої сполуки кількість продукту реакції пропорційна інтенсивності забарвлення. Руйнування забарвленої сполуки відповідно характеризується зменшенням інтенсивності забарвлення, яке пропорційно кількості продукту реакції.
Колориметричне визначення складається з двох основних етапів: утворення (або руйнування) забарвленої сполуки і вимірювання інтенсивності забарвлення.
Основним у колориметричному визначенні є хімічна реакція. В даному аналізі застосовуються реакції різних типів. Від вибору хімічної реакції залежать час, витрачений на аналіз, чутливість і точність методу. Той чи інший спосіб вимірювання інтенсивності забарвлення, хоч і має велике значення, але він зумовлений загальними умовами роботи лабораторії.
Для повного переведення іона, що визначають, у забарвлену сполуку необхідно врахувати такі характеристики:
1. Величину хімічного споріднення між реагуючими іонами. Цю величину характеризують константою нестійкості комплексу: чим менша ця константа, тим більша енергія споріднення між компонентами, тимбільш стійкий комплекс.
2. Сталість складу забарвлених сполук. Для колориметричного аналізу потрібно, щоб продукт реакції мав сталий склад, який би відповідав певній хімічній формулі. Причини зміни складу забарвлених сполук можуть бути різними:
- ступінчастий характер утворення забарвлених сполук,
- нестійкість забарвлених сполук у часі.
Тому у випадках зміни складу забарвлених сполук треба так проводити аналіз, щоб у стандартному і в досліджуваному розчинах утворювались однакові комплекси.
3. Спектр поглинання і інтенсивність забарвлення. Колір забарвлених розчинів залежить від нерівномірного поглинання світла різної довжини хвилі. Для характеристики кольору розчину користуються спектрами поглинання, або кривими поглинанн я, які характеризують розподіл поглинальної здатності розчину залежно від довжини хвилі. Знаючи спектр поглинання, можна вибрати максимально чутливу довжину хвилі для вимірювання оптичної густини розчину (інтенсивності забарвлення). Найкращим для колориметричного визначення є вузький спектр поглинання, тому що в цьому випадку оптичну густину речовини можна вимірювати навіть у присутності інших забарвлених сполук. Так, наприклад, розчин тіоціанатного комплексу кобальту найбільше поглинає світло при довжині хвилі 600 нм, тому при колориметричному визначенні кобальту оптичну густину треба вимірювати при Х == 600 нм.
Велике значення у колориметричному аналізі має інтенсивність поглинання розчину, віднесена до одного моля речовини, так званий молярний коефіцієнт поглинання. Молярним коефіцієнтом поглинання називають оптичну густину одномолярного розчину при товщині шару 1см. Чутливість колориметричного методу пропорційна величині молярного коефіцієнта поглинання.
Способи вимірювання інтенсивності забарвленн я поділяють на візуальні і фотоелектричні. При проходженні крізь забарвлений розчин монохроматичного пучка світла (світло певної довжини хвилі), частина його поглинається, а частина проходить крізь розчин, при цьому інтенсивність світла зменшується. Оптична густина розчину А, збільшується прямо пропорційно збільшенню вмісту речовини.
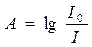 ,
,
де І0 - початкова інтенсивність пучка світла, І - інтенсивність пучка світла.
Закон Бугера — Ламберта — Бера має такий математичний вираз:
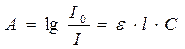
де  - молярний коефіцієнт поглинання, С –концентрація речовини, l - товщина забарвленого розчину. Концентрація С речовини виражають у молях на літр, товщину шару — в сантиметрах. При зміні концентрації або товщини шару забарвленого розчину прямо пропорційно змінюється оптична густина розчину, а не поглинання світла у процентах, яке змінюється відповідно до логарифмічного виразу.
- молярний коефіцієнт поглинання, С –концентрація речовини, l - товщина забарвленого розчину. Концентрація С речовини виражають у молях на літр, товщину шару — в сантиметрах. При зміні концентрації або товщини шару забарвленого розчину прямо пропорційно змінюється оптична густина розчину, а не поглинання світла у процентах, яке змінюється відповідно до логарифмічного виразу.
При вимірюванні інтенсивності забарвлення досягають оптичної рівності інтенсивності двох світлових потоків, які проходять крізь розчин з речовиною, яку визначають, і крізь стандартний розчин — розчин порівняння, в якому вміст речовини відомий.
З математичного виразу закону Бугера — Ламберта — Бера видно, що змінними величинами є оптична густина розчину А, концентрація забарвленої сполуки С і товщина шару l. Порівняти два світлові потоки можна неозброєним оком (візуальний спосіб) і за допомогою фотоелектричних приладів (фотоелектричний спосіб). В основі всіх візуальних способів лежить порівняння двох світлових потоків різної інтенсивності, що можна досягти, змінюючи концентрацію речовини, товщину шару або інтенсивність світлового потоку.
Оптичної рівності двох світлових потоків можна досягти за допомогою спеціальних приладів — колориметрів, змінюючи товщину шару розчину. Такі прилади, як фотометри зрівнюють світлові потоки, послабляючи інтенсивніший з них.
Метод стандартних серій (шкали). Інтенсивність забарвлення досліджуваного розчину порівнюють з інтенсивністю забарвлення стандартних розчинів серії, для виготовлення якої беруть 10—15 однакових пробірок, у першу наливають 0,1мл стандартного розчину, у другу — 0,2мл і т. д., збільшуючи його кількість за геометричною прогресією. Потім добавляють усі реактиви, потрібні для утворення забарвленої сполуки. Аналогічно обробляють досліджуваний розчин. Вміст речовини в досліджуваному розчині дорівнюватиме вмісту речовини в стандартному розчині з однаковим забарвленням.
Метод колориметричного титрування. Дві однакові пробірки діаметром 2—2,5см і висотою 25—30см вставляють у штатив, в обидві пробірки наливають реактиви, в першу — досліджуваний розчин, а в другу поступово добавляють стандартний (з відомою концентрацією речовини) розчин із бюретки. Стандартний розчин добавляють доти, поки інтенсивність забарвлення обох розчинів не зрівняється при однакових об'ємах. Розчини в обох пробірках весь час перемішують. Вміст речовини знаходять за об'ємом добавленого стандартного розчину. Це легко зробити, тому що концентрація стандартного розчину відома.
Перевага методу колориметричного титрування перед методом шкали в тому, що цей метод можна застосувати тоді, коли забарвлена сполука недостатньо стійка в часі (тіоціанат заліза).
Колориметр. У колориметрах порівнюють інтенсивність забарвлення, змінюючи товщину шару розчину. Досліджуваний і стандартний розчин наливають у циліндричні скляні посудини, які за допомогою спеціальних механізмів можуть опускатись і підніматись. У ці циліндри вільно входять нерухомо закріплені скляні палички з оптичного скла. При опусканні чи підніманні циліндрів змінюється товщина шару забарвленого розчину, що фіксується на спеціальних шкалах, з'єднаних через показник рівня розчину з циліндрами. Однакова товщина шару в обох циліндрах при однаковій інтенсивності забарвлення обох половин поля зору свідчить про однаковість концентрацій обох розчинів. Однаковості поля зору можна досягти, змінюючи товщину шару одного з розчинів. Концентрацію досліджуваного розчину обчислюють за формулою:

 , де Сх,Сст. — концентрації досліджуваного і стандартного розчинів; lx, lст. — відповідно товщини шару розчинів.
, де Сх,Сст. — концентрації досліджуваного і стандартного розчинів; lx, lст. — відповідно товщини шару розчинів.
Фотоколориметри. Вимірювати інтенсивність забарвлення можна не тільки візуальними методами, а й фотоелектричними. Ці методи ґрунтуються на використанні різних типів фотоелементів. Прилади, якими вимірюють інтенсивність забарвлення за допомогою фотоелементів, називають фотоколориметрами. У фотоколориметрах вимірюють різницю фотострумів у двох фотоелементах, на які падає світло, пройшовши крізь кювети з досліджуваним розчином і розчином порівняння. Фотоелементи сполучені між собою за принципом протитечії, гальванометр показує різницю фотострумів. Якщо інтенсивність забарвлення обох розчинів (досліджуваного і порівняння) однакова, то на обидва фотоелементи падає світло однакової інтенсивності, фотоструми двох елементів компенсуються і стрілка гальванометра не відхиляється.
У хімічних лабораторіях поширені фотоколориметри ФЕК-М, ФЕК-Н-57, ФЕК-Н-56 та КФК-2. Фотоколориметр ФЕК-Н-57 має перевагу перед іншими — у нього є 11 світлофільтрів. Ширина пропускання кожного з цих світлофільтрів досить мала, і світло, яке проходить крізь світлофільтр, наближається до монохроматичного. Це забезпечує високу точність вимірювання інтенсивності забарвлення. Кожний фотоколориметр випускається з інструкцією користування, де подається схема приладу і описані правила роботи з ним.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3916; Нарушение авторских прав?; Мы поможем в написании вашей работы!