
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівновага в масообміних процесах
|
|
|
|
Рівновага – це такий стан, при якому швидкість прямого і оберненого процесу вирівнюються і не відбувається зміна концентрацій x i y в І і ІІ
фазах.
Рівновага визначається дослідним шляхом і описується залежністю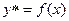 .
.
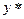 – означає рівноважну концентрацію по відношенню до х.
– означає рівноважну концентрацію по відношенню до х.
Якщо концентрації невеликі рівноважна залежність має лінійний характер  ,
,

m – коефіцієнт (tgα) називають коефіцієнтом розподілу. Це рівняння можна застосувати навпаки і визначити 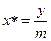 .
.
Приклад: розглянемо абсорбцію аміаку з повітря водою.
 Схематично Фy(газова фаза) _____________ границя
Схематично Фy(газова фаза) _____________ границя


 Фх(рідка фаза) розподілу
Фх(рідка фаза) розподілу
 – це масова концентрація
– це масова концентрація 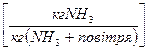 аміаку у повітрі
аміаку у повітрі
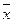 – масова концентрація
– масова концентрація 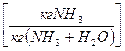 аміаку у воді
аміаку у воді
якщо  >
> *, тобто робоча концентрація більша за рівноважну, то процес буде іти в сторону досягнення рівноваги і у буде зменшуватися, а х – зростати. Схематично це зображуємо як напрямок стрілок з фази Фу у фазу Фх.
*, тобто робоча концентрація більша за рівноважну, то процес буде іти в сторону досягнення рівноваги і у буде зменшуватися, а х – зростати. Схематично це зображуємо як напрямок стрілок з фази Фу у фазу Фх.
Якщо розглядати граничну концентрацію газу в рідині (її означають як розчинність), то позначення її буде 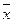 *.
*.
Рівновага підпорядковується правилу фаз – (Гібса):
| Ф+С=К+2 |
Ф- кількість фаз, С- кількість компонентів, К- кількість степенів вільності, що описують умови рівноваги.
Розглянемо як приклад процес абсорбції NH3
Ф=2 (рідина і газ); К=3 (NH3, H2O і повітря); С=К+2-Ф=3+2-2=3; (незалежні t0, P і одна з концентрацій, наприклад х). Тоді у*=f(x,P,t0), а коли будуємо графічну залежність у*=f(x) витримуємо t=const, Р=const

Змінюючи t i P змінюється положення лінії рівноваги, а в подальшому рушійну силу як різницю між робочою і рівноважною концентраціями.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 309; Нарушение авторских прав?; Мы поможем в написании вашей работы!