
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Роль реакции окисления углерода
|
|
|
|
Содержание углерода в стали значительно меньше, чем в чугуне, поэтому сталеплавильные процессы почти всегда сопровождаются реакцией окисления углерода, которую часто называют основной реакцией получения стали.
Углерод является главным потребителем кислорода, подводимого в ванну для окисления примесей. Например, в конвертерном и мартеновском скрап-рудном процессе до 75-80% и более кислорода расходуется на окисление углерода, поэтому управление процессом окислительного рафинирования во многих случаях сводится главным образом к регулированию реакции окисления углерода.
Удаление углерода из металлического расплава может протекать в зависимости от источника кислорода по следующим реакциям:
- кислород газовой фазы [С] + 1/2{О2} = {СО}; (7.2‑1)
- кислород расплава [С] + [О] = {СО}; (7.2‑2)
- кислород оксидов железа шлака [С] + (FeО) = {СО}+ [Fe]. (7.2‑3)
Рассмотрим возможность протекания реакции (7.2-2). Условие реакции – образование газообразного продукта {СО}. Таким образом, протекание реакции возможно при соблюдении следующего условия: давление газа СО (Рсо) должно преодолеть внешнее давление
Рсо³Рв , (7.2‑4)
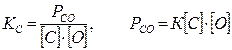 , (7.2‑5)
, (7.2‑5)
где Рв - внешнее давление, которое можно выразить для пузырька единичного размера следующим образом
Рв = Ро+ Н×g + Ркап, (7.2‑6)
где Ро - атмосферное давление; (Н×g) - гидрастатическое давление; Ркап = 2s/r - капиллярное давление, связано с наличием избыточной поверхности раздела фаз; Н - высота столба жидкости над пузырьком газа; g - плотность жидкости; r - радиус кривизны поверхности (радиус пузыря); s - поверхностное натяжение на границе фаз.
Следовательно, внешнее давление можно определить по формуле
Рв = Ро+ Н×g + 2s / r. (7.2‑7)
Условие (7.2-4) перепишем с учетом соотношений (7.2-5) и (7.2-6)
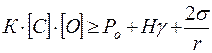 . (7.2‑8)
. (7.2‑8)
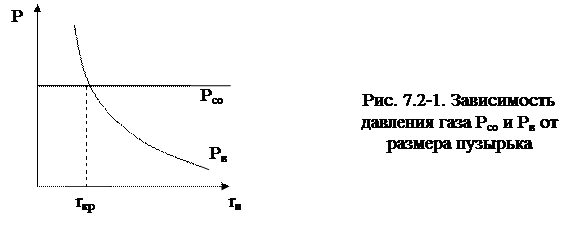
Представим это условие в зависимости от радиуса пузыря (рис. 7.2-1).
 |
Ро + Н×g
Очевидно, что условие протекания реакции окисления углерода (7.2-2) выполняется в случае, когда размер образующегося пузырька газа {СО} будет больше определенного критического размера, то есть Рсо ≥ Рв, когда r > rкр. В условиях сталеплавильного процесса rкр = 0,045 см.
Таким образом, окисление углерода возможно лишь тогда, если в жидком металле имеются газовые полости размером больше критических. Такие полости имеются на границе раздела металла с огнеупорной футеровкой агрегатов. Они представляют собой поры огнеупорной футеровки, не смачиваемые металлом, с размером r > rкр. Пузырь газа {СО} зарождается на границе раздела, отрывается и всплывает (рис. 7.2-2), т.к. металл не смачивает поры, то процесс повторяется бесконечно.

Фронтом реакции окисления углерода является граница раздела металл-футеровка, то есть в реакции участвует кислород растворенный в металле. Следовательно, это реакция окисления углерода (7.2-2).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 338; Нарушение авторских прав?; Мы поможем в написании вашей работы!