
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение вирулентности и конкурентоспособности клубеньковых бактерий
|
|
|
|
Вводные пояснения. Вирулентность клубеньковых — способность этих бактерий проникать в клетки корня растения, там размножаться и вызывать образование клубеньков — определяют по времени появления первого видимого клубенька. Критерием вирулентности может быть также доза инокулюма — «инфекционная нагрузка», «запас инфицирующего начала» для осуществления процесса инфицирования в максимально короткие сроки.
Отбор вирулентных культур ризобий мелкосемянных растений методом Фэреуса. Два предметных стекла толщиной 0,7—0,8 мм с проложенной между ними с одного конца стеклянной пластинкой располагают так, что - 6ы край одною стекла выступал нал краем другого примерно на 3—5 мм, и прочно перевязывают их нитками (рис. 32).
|
Укачанное расположение удобно для дальнейшею заполнения агаром пространства между стеклами и посева семян. Стеклянные пластинки для прокладки готовят из тонких предметных стекол, разрезая их на 3 части.
Систему стекол Фэреуса ставят и чашку Петри и стерилизуют в автоклаве. После стерилизации и заполнении агаризованной средой пространства между стеклами по две таких системы помешают в пробирки (180x40 мм) с жидкой питательной средой (60 мл на пробирку). Состав агаризованной (0,6% агара) и жидкой среды одинаков (г/л дистиллированной воды): СаС12 — 0,1; MgSO4·7H2O - 0.12; КН2РО4 - 0,1; К2НРО4 — 0,15; лимонно-кислое железо — 0,005; Мо, Сu, В, Fе, Мn - следы.
Предварительно рН среды доводят до 6,6 серной кислотой, затем стерилизуют в автоклаве при 0,5 атм. 30 мин.
Одновременно стерилизуют семена. Существуют разные способы стерилизации семян. Один из наиболее распространенных способов следующий: сначала семена обрабатывают спиртом (для лучшей их смачиваемости), затем промывают стерильной водой и помещают в большие стерильные колбы с 0,1%-ным раствором сулемы (или 1%-ной бромной водой) и выдерживают мелкие семена в течение 2 - 3 мин, а крупные — в чеченце 4—5 мин. По прошествии срока обработки семена неоднократно промывают стерильной водой, соблюдая правила асептики. Стерилизовать, семена можно также по Nutman концентрированной серной кислотой (см. 12.5.2).
Отобранные простерилизованные семена помешают в чашку Петри с фильтровальной бумагой и оставляют в тонком слое стерильной воды. Посев проводят через сучки. К тому времени семена прорастают (длина проростков — 3—5 мм). Пространство между предметными стёклами в подготовленной системе заполняют расплавленной агаризованной минеральной средой с помощью стерильных пипеток. После застывания агара в каждую систему помещают по три проростка. Посев проводят асептически. Далее по две таких системы устанавливают в пробирки с жидкой минеральной средой. Через сутки семена и среду инокулируют 3 каплями густой суспензии двухсуточной культуры клубеньковых бактерий.
Для исследований под микроскопом через 4—5 сут после посева, соблюдая условия асептики, осторожно стерильным пинцетом вынимают одну систему. Бритвой разрезают нитки. Одно предметное стекло удаляют. На агар наносят каплю воды, на нее помещают покровное стекло и корни просматривают под микроскопом.
Определение конкурентоспособности клубеньковых бактерий. Конкурентоспособность — это способность вирулентного штамма клубеньковых бактерий в присутствии других вирулентных штаммов обеспечивать преимущественное инфицирование бобового растения. Ее можно выявить только при наличии двух или нескольких штаммов в зоне корня растения.
Основное условие при определении конкурентоспособности — проверка ее только у штаммов заведомо одинаково вирулентных или даже более вирулентных по сравнению с тем, который оценивают. Иначе можно допустить ошибку, приняв за более конкурентоспособный более вирулентный штамм.
Критерий конкурентоспособности — количество клубеньков, образуемых каждым из вирулентных штаммов при их одновременном воздействии на растение. Правильнее конкурентоспособность определять в лабораторных, строго контролируемых условиях. Для этой цели применяют серологический метод и метод метки штамма-мутанта по его антибиотикоустойчивости.
При серологическом методе оценки конкурентоспособности ризобий для иммунизации кроликов в качестве антигенов используют суспензии 2—3-суточных культур быстрорастущих и 5—7-суточных культур медленнорастущих штаммов в физиологическом растворе (2 мл на скошенный агар). Для освобождения от неспецифических Н-антигенов суспензии прогревают в течение 30 мин на кипящей водяной бане и выдерживают 1 сут в холодильнике.
Иммунизацию осуществляют в ушную вену кроликов-самцов массой 3,5—4,5 кг возрастающим количеством инфицирующего материала. Всего вводят не менее 20 млрд. клеток с интервалом в 3 дня. Курс иммунизации — 6—8 инъекций.
Кровь у опытных животных берут на 7-й день после последней иммунизации из наружной краевой вены уха. Собирают ее в стерильный сосуд, смоченный физиологическим раствором, ставят на 1 ч в термостат при 37 °С.
Кровяной сгусток отделяют от стенок пипеткой Пастера и ставят сосуд на 18—20 ч в холодильник при 4—10°С. Затем пипеткой Пастера отделяют отстоявшуюся сыворотку (антисыворотку) и переносят ее в стерильные пробирки. Консервировать сыворотку можно тимолом или борной кислотой (2 г на 100 мл), но лучше хранить ее в лиофилизированном состоянии.
Для реакции преципитации методом Оухтерлони используют максимально чистый прозрачный агар (лучше агар Дифко). В стерильные чашки Петри заливают расплавленный агар слоем 3—4 мм. После застывания при помощи специального штампа в агаре вырезают лунки диаметром 3—4 мм. Удобнее использовать штамп из 7 трубочек: 1 — центральная и 6 — по окружности на расстоянии 8 мм друг от друга. В лунки пипетками Пастера наливают: в центральную — антисыворотку, в периферийные — растворы антигенов. Заполнять лунки следует быстро, аккуратно, не переливая жидкость через края и не касаясь их. Чашки помещают в эксикатор с водой на дне и тимолом в качестве антисептика. Реакцию проводят при 20 °С.
Линии преципитации учитывают визуально на 2—4-й день. Если определяют долю того или иного штамма, участвующего в образовании клубеньков в почве, то, чтобы оценить его конкурентоспособность, в качестве антигена берут культуры клубеньковых бактерий, выделенные из клубеньков и приготовленные так, как описано выше.
Для оценки конкурентоспособности клубеньковых бактерий методом метки исследуемые штаммы культивируют на средах с возрастающими (от 10 до 1000 ед/мл) дозами антибиотика, в частности стрептомицина или канамицина. При этом происходит адаптация отдельных штаммов к высокой дозе антибиотика. При инокуляции такими резистентными штаммами можно определить, какое количество клубеньков образовано, и таким образом получить характеристику их конкурентоспособности.
Обычно исследуют не менее 100 клубеньков. После стерилизации поверхности клубеньков (см. 12.5.1) каждый клубенек отдельно раздавливают в капле стерильной воды и проводят посев в чашки со стрептомицином. Если клубенек образован резистентным вариантом, то на среде со стрептомицином отмечают рост клубеньковых бактерий.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1117; Нарушение авторских прав?; Мы поможем в написании вашей работы!
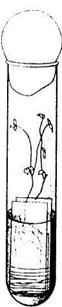 Рисунок 32 - Образование клубеньков на корнях проростков бобовых и системе стекол Фэреуса
Рисунок 32 - Образование клубеньков на корнях проростков бобовых и системе стекол Фэреуса