
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Роль приборов в исследовании микрообъектов
Мы не можем однозначно предсказать результат эксперимента. Это следствие корпускулярно-волнового дуализма. Кроме того, всякое измерение - это взаимодействие объекта и прибора. Это воздействие нарушает реальное состояние объектов и таким образом показатели прибора имеют погрешности. Мы не можем так же обеспечить бесконечно малые взаимодействия (нельзя взять десятую часть фотона). Явления и наблюдения неотделимы друг от друга. Все измерения создает новое состояние.
У электрона есть свойства, которые не зависят от способа наблюдения (масса, заряд, механический и магнитный моменты).
При описании атома:

 .e
.e
+
 |
Электрон подобен току, ток создает магнитное поле, магнитное поле создает орбитальный момент. Электрон обладает собственный магнитный момент.
Современные физики считают, что эти моменты врожденные.
Состояние электрона в атоме описывают четырьмя квантовыми числами:
n – главное квантовое число.
l – орбитальное квантовое число (азимутальное).
m – магнитное квантовое число.
s – спиновое квантовое число.
Соответствие периодического закона квантовой механике (Лекция 6)
Главное квантовое число характеризует энергию электрона. Показывает номер энергетического уровня и период. Обозначается символом «n» и принимает значения от 1 до бесконечности.
Орбитальное квантовое число характеризует форму обитали. Обозначается символом «l» и принимает значения от 0 до n-1. Электрон на первом энергетическом уровне в атоме характеризуется n=1 l=0. Цифровые значения l заменены на буквенные. Соответственно 0-s, 1-p, 2-d, 3-f, 4-g, 5-h и так далее.
Магнитное квантовое число характеризует расположение обитали в пространстве. Обозначается символом «m» и принимает значения от –l,...0…+l. Например, самый внешний электрон атома алюминия характеризуется следующими квантами числами: n=3 l=1 m=-1 или m=0 или m=+1. Соответственно, орбиталь располагается в пространстве по осям х, у, z.
Спиновое квантовое число характеризует направление движения электрона в атоме по орбитали. Обозначается символом «s» и принимает значения ±1/2.
Таблица №1
| n | l | m | Тип орбитали |
| n=1 | l=0 | m=0 | 1s |
| n=2 | l=0 l=1 | m=0 m=-1, 0, 1 | 2s 2px, 2py, 2pz. |
| n=3 | l=0 l=1 l=2 | m=0 m=-1, 0, 1 m=±2, ±1, 0 | 3s
3px, 3py, 3pz.
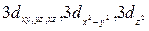
|
| n=4 | l=0 l=1 l=2 l=3 | m=0 m=-1, 0, 1 m=±2, ±1, 0 m=±3, ±2, ±1, 0 | 4s
4px, 4py, 4pz.
 4f (7 орбиталей)
4f (7 орбиталей)
|
и так далее
(Чежина Н.В.)
Принцип заполнения атомных орбиталей:
1) Принцип минимума энергии. Электроны стремятся, прежде всего, занять ближние к ядру орбитали с наименьшей энергией.
2) Принцип Паули. В атоме не может быть двух электронов характеризующихся одним и тем же набором квантовых чисел. На одной орбитали могут находиться только два электрона.
3) Правило Хунда. На одной орбитали электроны располагаются так, чтобы их суммарный спин был максимальным.
4) Правило Клячковского. Заполнение орбитали идет не по возрастанию n, а по возрастанию n+l. А при одинаковой сумме n+l сначала заполняются орбитали с меньшим n.
В периоде потенциал ионизации растет. 3-d переходные элементы проявляют различную валентность и степень окисления. (Повторить порядок заполнения оболочек атомов химических элементов в периодической системе Д.И Менделеева).
|
|
Дата добавления: 2014-01-04; Просмотров: 272; Нарушение авторских прав?; Мы поможем в написании вашей работы!