
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состояние реальных газов
|
|
|
|
При повышенных давлениях для реальных газов характерно межмолекулярное взаимодействие, молекулы газов начинают притягиваться друг к другу, за счет физического взаимодействия.
Для учёта этого взаимодействия уравнение 2.17 на протяжении многих лет модифицировалось (голландским физиком Ван–дер–Ваальсом и др.). Однако на практике используется уравнениеМенделеева–Клапейрона для реальных газов, содержащее коэффициент сверхсжимаемости z, предложенный Д. Брауном и Д. Катцом и учитывающий отклонения поведения реального газа от идеального состояния:
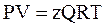 , (2.26)
, (2.26)
где Q – количество вещества, моль;
z – коэффициент сверхсжимаемости газа (см. 2.8).
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Менделеева–Клапейрона для высоких давлений.
Коэффициент z зависит от давления и температуры (приведенных, критических давлений и температур), природы газа:
z = f (Тприв, Рприв), (2.27)
где Тприв – приведенная температура;
Рприв – приведенное давление.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (температура, давление, объём, плотность и др.) больше или меньше критических.
Тприв.. = Тпл. / Тср. кр; Р прив. = Рпл. / Рср. кр; Vприв. = Vпл. / Vср. кр. (2.28)
А для смесей газов они характеризуются отношением действующих параметров (температура, давление и др.) к среднекритическим параметрам смеси:
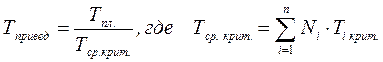 (2.29)
(2.29)
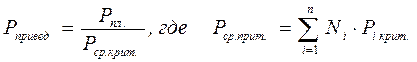 (2.30)
(2.30)
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние (табл. 2.4.).
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние (табл. 2.4).
Таблица 2.4
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!