
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые состояния углеводородных смесей
|
|
|
|
Схема фазовых превращений однокомпонентных систем
ФАЗОВЫЕ СОСТОЯНИЯ УГЛЕВОДОРОДНЫХ СИСТЕМ
В процессе разработки месторождений в пластах непрерывно изменяются давление, температура. Это сопровождается непрерывным изменением состава газовой и жидкой фаз и переходом различных углеводородов из одной фазы в другую. Особенно быстро такие превращения происходят при движении нефти по стволу скважины от забоя к устью.
Дальнейшее движение нефти и газа к потребителю также сопровождается непрерывными фазовыми превращениями. Закономерности фазовых переходов и фазовое состояние газонефтяных смесей при различных условиях необходимо знать для решения многих задач.
- Интенсивность выделения газовой фазы из нефти зависит от многих факторов, основными из которых являются:
- Темп снижения давления и температуры при движении нефтяного потока;
- Наличие в составе нефти лёгких углеводородов (С2–С6);
- Молекулярная масса нефти;
- Вязкость нефти.
Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении давления и температуры. На рис. 4.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка. Слева от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок – двухфазной газожидкостной области, левый участок – жидкой фазе. Отрезок пунктирной линии вправо от максимума в точке С называется кривой точек конденсации (или точек росы), а влево от максимума – кривой точек парообразования (кипения). В точке С пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать.
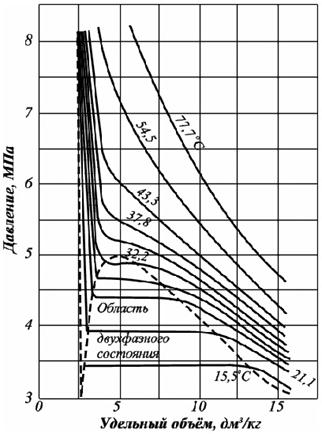
Рис. 4.1. Диаграмма фазового состояния чистого этана
Для индивидуальных углеводородов граничным давлением (при данной температуре) между жидкой и газовой фазой является давление упругости паров, при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью. Давление, при котором газ начинает конденсироваться, называется давлением насыщения для газа.
Фазовые превращения углеводородов можно также представить в координатах давление-температура (рис. 4.2). Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии.
Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой С (рис. 4.2). Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.

Рис. 4.2. Диаграмма фазового состояния чистого этана в координатах Т-Р
Из рисунка 4.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки А (рис. 4.2), можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки Е), а затем при снижении давления до точки F вещество приобретёт свойства жидкости, минуя область двухфазного состояния.
Значительно сложнее закономерности фазовых переходов двух- и многокомпонентных систем. С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их от поведения однокомпонентного газа.
В смеси углеводородов каждый компонент имеет собственные значения упругости насыщенных паров, поэтому процессы конденсации и испарения не будут проходить при конкретных значениях давления и температуры, а в определённом диапазоне значений давления и температуры. Границы диапазона будут тем больше, чем больше разница между критическими значениями давления и температуры индивидуальных компонентов, входящих в систему.
Изотермическое сжатие системы будет приводить к конденсации сначала более тяжелого компонента, затем более легкого. В результате изотермы в двухфазной области имеют наклон (рис. 4.3, а). С появлением в системе второго компонента большие различия появляются и в диаграммах "давление – температура" (рис. 4.3, б).
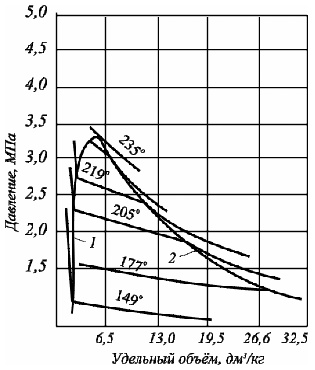

Рис. 4.3. Диаграммы фазового состояния бинарных систем: а. - зависимость "давление – удельный объём" для смеси н-С5Н12 – н-С7Н16; б. – диаграмма "давление-температура" для смеси C2Н6 – н-С7Н16
Крайние левая и правая кривые соответствуют давлениям насыщенных паров для легкого (слева) и более тяжелого компонента (справа). Между ними расположены фазовые диаграммы смесей.
Для многокомпонентных систем, в силу их неидеальности, возможны существование двух фаз при температурах или давлениях выше критических величин. Явления существования двух фаз при изотермическом или изобарическом расширении (сжатии) смеси в области выше критических температур и давлений называются ретроградными явлениями или процессами обратного испарения и конденсации. Изотермические ретроградные явления происходят только при температурах выше критической и ниже максимальной двухфазной температуры. Изобарические процессы испарения и конденсации наблюдаются между критическим и максимальным двухфазным давлением. Такие явления характерны, в основном, для газоконденсатных месторождений, имеющих высокие пластовые температуры и давления.
Степень насыщения газоконденсатной залежи высококипящими углеводородами (конденсатом) определяется величиной газоконденсатного фактора. По аналогии с газовым фактором (Го) для нефтяных месторождений понятие газоконденсатный фактор (Ко) применяется для конденсатных залежей. Газоконденсатный фактор - представляет собой отношение количества (дебита) газа в м3 к количеству стабильного конденсата в м3. Величина, обратная газоконденсатному фактору, называется выход конденсата.
Нефть и конденсат полученные, непосредственно, на промысле при данных температурах и давлениях, называются сырыми. Нефть и конденсат, прошедшие процессы дегазации (сепарации), стабилизации при стандартных условиях называются стабильными.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1812; Нарушение авторских прав?; Мы поможем в написании вашей работы!