
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постоянная Авогадро
|
|
|
|
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело. NA – это постоянная Авогадро. Количество вещества измеряется в молях. Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856). В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1 Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы. Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1). Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
36 вопрос
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц и др.[1
|
|
|
Уравнение состояния термодинамической системы представляет собой аналитическую формулу, связывающую параметры состояния системы. Если состояние системы может быть полностью описано с помощью трех параметров: давления 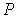 , объема
, объема  и температуры
и температуры  , то уравнение состояния в самом общем виде будет иметь форму:
, то уравнение состояния в самом общем виде будет иметь форму:
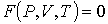 . .
| (2.1) |
Конкретный вид этой формулы зависит от физических свойств рассматриваемой термодинамической системы.
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемым уравнением Клапейрона-Менделеева:
 , ,
| (2.2) |
где:  - давление газа,
- давление газа,  - занимаемый им объем,
- занимаемый им объем,  - количество молей газа,
- количество молей газа,  - универсальная газовая постоянная,
- универсальная газовая постоянная,  - абсолютная температура. Уравнение (2.2) названо в честь французского физика Бенуа Поля Эмиля Клапейрона (1799 - 1864) и русского химика Дмитрия Ивановича Менделеева (1834 - 1907).
- абсолютная температура. Уравнение (2.2) названо в честь французского физика Бенуа Поля Эмиля Клапейрона (1799 - 1864) и русского химика Дмитрия Ивановича Менделеева (1834 - 1907).
В рамках термодинамического подхода газ, уравнение состояния которого, связывающие параметры 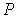 ,
,  , и
, и  , является уравнением Клапейрона-Менделеева (2.2), называется идеальным газом. При нормальных условиях наиболее близкими по своим свойствам к идеальному газу являются водород и гелий.
, является уравнением Клапейрона-Менделеева (2.2), называется идеальным газом. При нормальных условиях наиболее близкими по своим свойствам к идеальному газу являются водород и гелий.
| Законы идеального газа |
Давление p, объем V и температура T идеального газа связаны между собой уравнением Менделеева–Клапейрона:
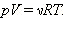
|
Здесь ν – количество вещества, R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Если температура газа остается постоянной, то выполняется закон Бойля–Мариотта:
|
|
|
| pV = const. |

|
| Рис. 1. Изотермический процесс |
Если постоянным остается давление, то выполняется закон Гей-Люссака:
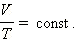
|
|
| Рис. 2. Изобарный процесс |
Наконец, если постоянен объем, то справедлив закон Шарля:

|
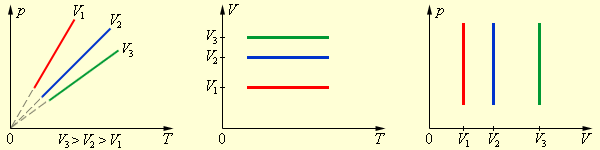
|
37 вопрос
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 ,
,
где
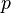 — давление,
— давление,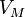 — молярный объём,
— молярный объём,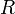 — универсальная газовая постоянная
— универсальная газовая постоянная — абсолютная температура,К.
— абсолютная температура,К.
Так как  , где
, где  — количество вещества, а
— количество вещества, а  , где
, где 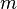 — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:

Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.Уравнение, выведенное Клапейроном содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:

Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна  , коэффициент пропорциональности
, коэффициент пропорциональности 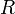 он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1830; Нарушение авторских прав?; Мы поможем в написании вашей работы!