
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физический смысл адиабатического процесса
|
|
|
|
Вопрос
Вопрос
Вопрос
Вопрос
Вопрос
Газовой смесью понимается смесь отдельных газов, вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же оюъеме и при той же температуре, что и в смеси.
Газовая смесь подчиняется закону Дальтона:
║Общее давление смеси газов равно сумме парциальных давлений ║отдельных газов, составляющих смесь.Р = Р1 + Р2 + Р3 +...Рn = ∑ Рi, (2.14)где Р1, Р2, Р3...Рn – парциальные давления.
Состав смеси задается объемными, массовыми и мольными долями, которые определяются соответственно по следующим формулам:r1 = V1 / Vсм; r2 = V2 / Vсм; … rn = Vn / Vсм, (2.15)
g1 = m1 / mсм; g2 = m2 / mсм; … gn = mn / mсм, (2.16)
r1′ = ν1 / νсм; r2′ = ν2 / νсм; … rn′ = νn / νсм, (2.17)где V1; V2; … Vn; Vсм –объемы компонентов и смеси;
m1; m2; … mn; mсм – массы компонентов и смеси;
ν1; ν2; … νn; νсм – количество вещества (киломолей)
компонентов и смеси.
Для идеального газа по закону Дальтона:r1 = r1′; r2 = r2′; … rn = rn′. (2.18)Так как V1 +V2 + … + Vn = Vсм и m1 + m2 + … + mn = mсм, то r1 + r2 + … + rn = 1, (2.19)
g1 + g2 + … + gn = 1. (2.20)Связь между объемными и массовыми долями следующее:g1 = r1∙μ1/μсм; g2 = r2∙μ2 /μсм ; … gn = rn∙μn /μсм, (2.21)где: μ1, μ2, … μn, μсм – молекулярные массы компонентов и смеси.
Молекулярная масса смеси:μсм = μ1 r1 + r2 μ2+ … + rn μn. (2.22) Газовая постоянная смеси:Rсм = g1 R1 + g2 R2 + … + gn Rn =
= Rμ (g1/μ1 + g2/μ2+ … + gn/μn ) =
= 1 / (r1/R1 + r2/R2+ … + rn/Rn). (2.23) Удельные массовые теплоемкости смеси:ср см. = g1 ср 1 + g2 ср 2 + … + gnср n. (2.24)
сv см. = g1ср 1 + g2сv 2 + … + gnсv n. (2.25) Удельные молярные (молекулярные) теплоемкости смеси:
срμ см. = r1 срμ 1 + r2 срμ 2 + … + rnсрμ n. (2.26)
сvμсм. = r1сvμ 1 + r2сvμ 2 + … + rnсvμ n. (2.27)
Формула для среднего давления газа на стенку сосуда запишется в виде
|
Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m0, концентрацией молекул n, средним значением квадрата скорости 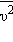 и средней кинетической энергией
и средней кинетической энергией 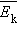 поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов
поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
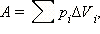
|
или в пределе при ΔVi → 0:

|
В изохорном процессе (V = const) газ работы не совершает, A = 0.
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением:
| A = p (V2 – V1) = pΔV. |
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.Работа газа в адиабатическом процессе выражается через температуры T1 и T2 начального и конечного состояний
| A = CV (T2 – T1). |
Модель может быть использована в режиме ручного переключения кадров и в режиме автоматической демонстрации
Тема 2. ТЕПЛОЁМКОСТЬ ГАЗОВ
2.1.Массовая, объёмная и мольная удельные теплоёмкости
Известно, что подвод теплоты к рабочему телу или отвод теплоты от него в каком-либо процессе приводит к изменению его температуры. Отношение количества теплоты, подведенной (или отведенной) в данном процессе, к изменению температуры называется теплоемкостью тела (системы тел):
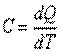 , ,
| (2.1) |
где  — элементарное количество теплоты;
— элементарное количество теплоты; 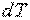 — элементарное изменение температуры.
— элементарное изменение температуры.
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить ее температуру на 1 градус. Так как единицей количества теплоты в СИ является джоуль, а температуры — градус К, то единицей теплоемкости будет Дж/К.
В зависимости от внешних условий и характера термодинамического процесса теплота 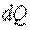 может либо подводиться к рабочему телу, либо отводиться от него. Учитывая, что система участвует в бесчисленном множестве процессов, сопровождающихся теплообменом, величина
может либо подводиться к рабочему телу, либо отводиться от него. Учитывая, что система участвует в бесчисленном множестве процессов, сопровождающихся теплообменом, величина 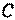 для одного и того же тела может иметь различные значения. В общем случае значение теплоёмкости
для одного и того же тела может иметь различные значения. В общем случае значение теплоёмкости 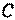 лежит в интервале от -∞ до +∞, то есть она может быть любой положительной или отрицательной величиной.
лежит в интервале от -∞ до +∞, то есть она может быть любой положительной или отрицательной величиной.
Поэтому обычно в выражении (2.1) при теплоёмкости 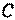 указывается индекс "x", который характеризует вид процесса теплообмена
указывается индекс "x", который характеризует вид процесса теплообмена
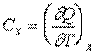 . .
| (2.2) |
Индекс "x" означает, что процесс подвода (или отвода) теплоты идет при постоянном значении какого-либо из параметров, например, давления 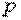 , объема
, объема 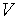 или других.
или других.
Ввиду того, что в термодинамике обычно рассматриваются квазистатические процессы теплообмена, теплоемкость 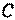 является величиной, относящейся к системе, которая находится в состоянии термодинамического равновесия. Таким образом, теплоемкости являются функциями параметров термодинамической системы. Для простых систем — это функции каких-либо двух из трех параметров:
является величиной, относящейся к системе, которая находится в состоянии термодинамического равновесия. Таким образом, теплоемкости являются функциями параметров термодинамической системы. Для простых систем — это функции каких-либо двух из трех параметров: 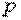 ,
, 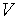 ,
, 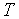 .
.
Опыты показывают, что количество теплоты, подведенное к рабочему телу системы или отведенное от него, всегда пропорционально количеству рабочего тела. Для возможности сравнения вводят, как известно, удельные величины теплоемкости, относя подведенную (или отведенную) теплоту количественно к единице рабочего тела.
В зависимости от количественной единицы тела, к которому подводится теплота в термодинамике, различают массовую, объемную и мольную теплоемкости.
Массовая теплоемкость — это теплоемкость, отнесенная к единице массы рабочего тела,
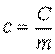 . .
|
Единицей измерения массовой теплоемкости является Дж/(кг • К). Массовую теплоемкость называют также удельной теплоемкостью.
Объемная теплоемкость — теплоемкость, отнесенная к единице объема рабочего тела,
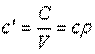 , ,
|
где 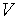 и
и 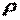 — объем и плотность тела при нормальных физических условиях.
— объем и плотность тела при нормальных физических условиях.
Объемная теплоемкость измеряется в Дж/(м3 • К).
Мольная теплоемкость — теплоемкость, отнесенная к количеству рабочего тела (газа) в молях,
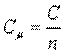 , ,
| (2.3) |
где  — количество газа в молях.
— количество газа в молях.
Мольную теплоемкость измеряют в Дж/(моль • К).
Массовая и мольная теплоемкости связаны следующим соотношением:
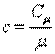
|
или
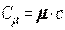 , ,
| (2.4) |
где 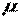 - молекулярная масса.
- молекулярная масса.
Объемная теплоемкость газов выражается через мольную как
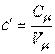
|
или
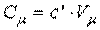 , ,
| (2.5) |
где  м3/моль — мольный объем газа при нормальных условиях.
м3/моль — мольный объем газа при нормальных условиях.
Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством
Если термодинамический процесс в общем случае являет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии[5], то адиабатический процесс в силу отсутствия теплообмена (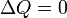 ) системы со средой сводится только к последним двум процессам[6]. Поэтому, первое начало термодинамики в этом случае приобретает вид[7][Комм 1]
) системы со средой сводится только к последним двум процессам[6]. Поэтому, первое начало термодинамики в этом случае приобретает вид[7][Комм 1]
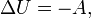
где 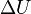 — изменение внутренней энергии тела,
— изменение внутренней энергии тела,  — работа, совершаемая системой.
— работа, совершаемая системой.
Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит[8]:

Здесь  — температура системы,
— температура системы, 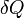 — теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла[8].
— теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла[8].
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 860; Нарушение авторских прав?; Мы поможем в написании вашей работы!
