
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные кристаллы
|
|
|
|
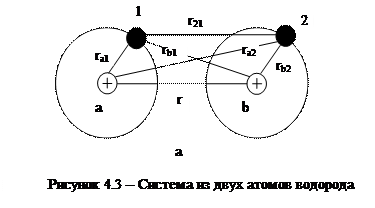
В узлах кристаллической решетки атомных кристаллов распложены нейтральные атомы. Силы взаимодействия между атомами в таких кристаллах называются обменными. Рассмотрим природу этих сил на примере молекулы водорода H2. Система из двух атомов водорода схематически изображена на рисунке 4.3. Протоны на схеме обозначены буквами а и b, a электроны - цифрами 1 и 2. Расстояния между элементами схемы обозначены буквой r.
 |
Плотность электронного облака, описывающего состояние электрона в атоме водорода, очень быстро падает с увеличением расстояния, поэтому при больших расстояниях между протонами атомы можно рассматривать как изолированные, а энергию системы, состоящей из двух удаленных атомов, можно считать равной 2Е0, где Е0 - энергия изолированного атома в невозбужденном состоянии.
По мере уменьшения расстояния r увеличивается степень перекрытия электронных облаков, т. е. увеличивается вероятность перехода электрона к «чужому» протону. Расчет показывает, что при r»50 электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет. Сблизим атомы на расстояние r»2
электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет. Сблизим атомы на расстояние r»2 . В этом случае электрон первого атома, может перейти ко второму, 1014 раз в секунду. Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов.
. В этом случае электрон первого атома, может перейти ко второму, 1014 раз в секунду. Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов.
Обобществление электронов приводит к перераспределению электронной плотности в пространстве между ядрами атомов и вне ядер. Плотность электронного облака в пространстве между ядрами становится больше плотности, которая бы получилась при простом сложении отдельных плотностей. При этом в пространстве вне ядер оказывается, что суммарная плотность электронного облака будет меньше той, которая бы получилась при сложении плотностей электронных облаков отдельных атомов.
Появление состояния с повышенной плотностью электронного облака в межъядерном пространстве вызывает уменьшение энергии системы и приводит к возникновению сил притяжения между ядрами. В основе возникновения такой связи лежит обменное взаимодействие или обменный эффект, обусловленный обменом атомов электронами и имеющий чисто квантовую природу. Силы такого взаимодействия называются обменными силами, а их энергия - обменной энергией.
Обменное взаимодействие возникает и между другими тождественными частицами, например, между протонами или между нейтронами, когда они сближаются до расстояний, обеспечивающих существенное перекрытие волновых функций этих частиц, что имеет место в атомном ядре.
Нужно отметить, что в зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может проявляться не только в возникновении сил притяжения, но и в возникновении сил отталкивания между сближающимися атомами.
Возникающая в результате обменного взаимодействия ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированных электронов. Это означает, что такая связь имеет направленный характер.
Вследствие того, что ковалентная связь возникает посредством взаимодействия валентных электронов, кристаллы, в которых атомы связаны такой связью, иногда называют валентными.
Представление о перекрывании электронных облаков соседних атомов и обменном направленном взаимодействии двух электронов с антипараллельными спинами составляют основу современной теории строения молекул. Эти представления дали простое объяснение загадочной способности химических сил к насыщению.
Действительно, к молекуле водорода не может присоединиться еще один атом водорода, так как спин его электрона будет параллелен спину одного из электронов, входящих в молекулу водорода, и между ними возникнут силы отталкивания, препятствующие присоединению третьего атома.
В атомных кристаллах тоже нельзя выделить отдельных группировок частиц, которые можно было бы назвать молекулами. Весь кристалл можно рассматривать как гигантскую молекулу с ковалентной связью. Однако при разрушении ковалентной связи, в отличии от ионной, никогда не возникает ионов.
Ковалентная химическая связь очень прочна, поэтому атомные кристаллы отличаются высокой температурой плавления, большой твердостью и малой летучестью.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1629; Нарушение авторских прав?; Мы поможем в написании вашей работы!