
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кристаллическое строение вещества
|
|
|
|
По физической культуре
Курс лекций
ФИЗИЧЕСКАЯ КУЛЬТУРА
Автор: Шокина Ирина Николаевна
Подписано в печать ________ 2011. Формат 60х84 1/16
Усл. печ. л. 6,0. Тираж 500 экз.
Саратовский институт (филиал)
Российский государственный торгово-экономический университет
410052, Саратов, ул. Международная, 24
Отпечатано в РИО Саратовского института (филиала)
Российского государственного торгово-экономического университета
410052, Саратов, ул. Международная, 24
1.1. Виды химических связей в кристаллических решетках
В силикатных системах в различной степени присутствуют химические связи различной природы, определяющие во многом физико-механические характеристики материалов.
Ионная связь осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов (например, ионов натрия и хлора в кристаллической решетке галита-поваренной соли). Ионная связь не обладает насыщенностью и склонна к деформациям. Разрушение кристаллических решеток, в которых преобладающий тип химической связи – иона, имеет пластический характер.
Ковалентная связь, обусловленная обобществлением электронных пар соседних атомов, характеризуется направленностью, насыщенностью. Разрушение кристаллических решеток, в которых преобладающий тип химической связи – ковалентная, имеет хрупкий характер.
Внутри молекул в молекулярных решетках возникают ионно-ковалентные связи, а между молекулами – межмолекулярное взаимодействие: слабые поляризационные (индукционные) силы Ван дер Ваальса между полярной и неполярной молекулами, дипольное взаимодействие (ориентационные силы) между полярными молекулами.
Силы межмолекулярного взаимодействия слабее ионно-ковалентных, но проявляются на больших расстояниях, чем последние.
1.2. Классы кристаллических решеток
Существуют три класса кристаллических решеток.
1. Координационные решетки (рис.1а) состоят из одинаковых, либо различных элементов, имеющих (решетки ионного типа) или не имеющих (решетки атомного типа) заряд.
Примерами решеток такого типа могут служить решетка алмаза (структурных элемент – углерод) и кремнезем (структурные элементы – кислород и кремний).
В решетках с различными элементами каждый атом или катион окружены атомами или анионами другого элемента, находящимися в вершинах координационного многогранника.
2. Сложные решетки (рис.1б) состоят из молекул или комплексных ионов, расположенных в узлах кристаллической решетки.
3. Слоистые решетки (рис.1в) образуются при односторонней поляризации, которая приводит к различию в расстоянии между ионами решетки в разных направлениях: С не равно D. Примером могут служить кристаллические решетки слоистых силикатов – талька, гидрослюд, графита.
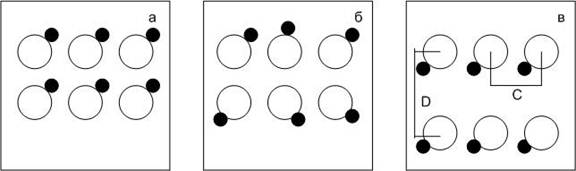
Рис.1. Классы кристаллических решеток:
а – координационные, б – сложные, в – слоистые
Кристаллические решетки силикатов представляют собой переходный тип между названными классами. Сохраняя координационное строение, они в то же время содержат симметричные анионные группы из ионов кислорода, фтора, гидроксил-иона с катионами в центре координационного многогранника.
1.3. Общие принципы построения координационных решеток
Решетки различных кристаллов отличаются друг от друга не только природой образующих их веществ, но и по взаимному расположению частиц в пространстве. Каждую решетку можно охарактеризовать элементарной ячейкой – наименьшей частью кристаллической решетки, имеющей все особенности ее структуры.
Число ближайших частиц для рассматриваемой частицы в кристалле называется ее координационным числом.
Например, в кристалле NaCl ионы расположены в вершинах куба и поэтому координационные числа как натрия, так и хлора равны 6. Силикаты имеют координационные решетки, в построении которых большую роль играют величины координационных чисел и ионных радиусов частиц. Кристаллохимия представляет ионы и атомы в кристаллической решетке как ²жесткие² сферы и устанавливает понятия эффективных ионных радиусов, определяющих расстояния между центрами соседних ионов или атомов: межплоскостное расстояние структуры кристаллической решетки d = R-аниона + R-катиона.
В реальных кристаллах из-за деформации электронной оболочки при электростатическом взаимодействии ионов величины ионных радиусов (а с ними и конфигурация ²жестких² сфер) могут изменяться (табл.1).
Таблица 1 – Величины ионных радиусов
| Ион | Радиус, нм | Ион | Радиус, нм |
| О2+ | 0,138 | Na+ | 0,098 |
| F- | 0,133 | K+ | 0,133 |
| Cl- | 0,181 | Mg2+ | 0,074 |
| Ca2+ | 0,104 | Al3+ | 0,057 |
| Si4+ | 0,039 |
Согласно принципу минимума потенциальной энергии кристаллической решетки, сформулированного В.М.Гольдшмидтом, каждый ее элемент стремится к взаимодействию с максимальным числом других частиц. Это приводит к образованию плотнейших упаковок элементов в узлах кристаллической решетки. Отношение радиуса катиона к радиусу аниона Rк/Rа при этом определяет нижнюю границу координационного числа. Уменьшение этого отношения приводит к увеличению потенциальной энергии и переводит систему в нестабильное состояние (рис.2).
Л.К.Полингом был сформулирован ряд правил построения координационных структур.
1. Каждый катион окружен анионами, находящимися в вершинах координационного полиэдра. Расстояние между центрами катиона и соседнего аниона определяется суммой ионных радиусов, а координационное число (КЧ) – их отношением E=Rк/Rа (рис.3).
2. Правило электростатической валентности: в устойчивой ионной структуре сумма сил электростатических связей, соединяющих анион с катионами, равна заряду аниона.
Сила связи – это отношение заряда катиона к числу окружающих его катионов. Сила связи катиона зависит от его координационного числа.
В сложных структурах это правило может не соблюдаться. При этом, если сумма сил связей и валентность катиона не совпадают более, чем на 1/6, структура решетки становится неустойчивой.
3. Устойчивость структур ионного типа зависит от наличия общих ребер полиэдров и особенно граней. Наличие общих структурных элементов снижает устойчивость структуры пространственной решетки.

Рис.2. Устойчивость структур координационного типа:
а – устойчивая структура, б – промежуточное положение, в – неустойчивая структура
Это правило особенно существенно для многозарядных катионов с малыми координационными числами: например, для кремния, при сближении которых развиваются большие силы отталкивания.
 |
Рис.3. Координационные многогранники:
а – гантель КЧ = 2, Е – менее 0,155;
б – треугольник КЧ = 3, Е = 0,155 … 0,225;
в – тетраэдр КЧ = 4, Е = 0,225 … 0,415;
г – октаэдр КЧ=6, Е = 0,415 … 0,732;
д – куб КЧ = 8, Е – более 0,732
Контрольные вопросы
1. Какие типы химических связей встречаются в структурах кристаллических решеток силикатов?
2. Покажите взаимосвязь между типами химических связей и свойствами материала.
3. Чем решетки координационного типа отличаются от решеток сложного типа?
4. В чем особенность строения решеток слоистого типа?
5. Что называется координационным числом элемента кристаллической решетки?
6. Какими параметрами кристаллической решетки определяется вид координационного полиэдра?
7. Будет ли изменяться вид полиэдра при замене хлора на фтор в соединениях с натрием?
8. Чем обусловлена неустойчивость структур кристаллических решеток при наличии общих граней полиэдров?
9. 9.Может ли один катион иметь разные координационные числа в различных структурах решеток?
Литература: основная [1], дополнительная [12, 15].
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 974; Нарушение авторских прав?; Мы поможем в написании вашей работы!