
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная связь
|
|
|
|
Возникновение ионной связи рассмотрим на примере образования хлорида натрия NaCl. Атомы натрия и хлора, из которых образовалось это соединение резко отличаются по электроотрицательности: для атома натрия она равна 0,9, для атома хлора – 3,0. Это атомы с незавершенными внешними электронными уровнями. Для образования устойчивой октетной оболочки внешнего энергетического уровня атому натрия легче отдать 1 электрон, а атому хлора принять 1 электрон по схеме
Na – e- = Na+
Cl + e- = Cl-
то есть электронная оболочка атома натрия превращается в устойчивую оболочку атома благородного газа Ne – 1s22s22p6 (это натрий-ион Na+), а оболочка атома Cl – в оболочку атома благородного газа Ar - 1s22s22p63s23p6 (это хлорид-ион Cl-). Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение NaCl.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется электровалентной или ионной связью. Соединения, которые образовались путем взаимодействия ионов, называются гетерополярными или ионными.
Ионные соединения образуют два элемента, резко отличных по электроотрицательности, например, атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп. Ионных соединений сравнительно немного.
Молекулы хлорида натрия NaCl существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют.
Ковалентная связь является более общим типом химической связи. Теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владение одного из соединяющихся атомов, в молекуле NaCl
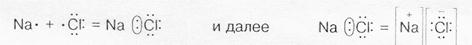
В приведенном примере предельная односторонняя поляризация производится атомом хлора, проявляющим неметаллические свойства (электроотрицательность χсl =3,0). Молекулярное электронное облако (электронная пара) полностью смещается к атому хлора. Это равносильно переходу электрона от атома натрия к атому хлора.
Очевидно, полярную ковалентную связь можно определить как разновидность ковалентной связи, которая претерпела лишь незначительную одностороннюю поляризацию (связующее электронное облако сместилось к атому с большей относительной электроотрицательностью). Она является промежуточной между ионной и неполярной ковалентной связями.
Таким образом, в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связями нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар.
Предсказать полярность связи можно на сравнении значений относительной электроотрицательности атомов элементов. Чем больше разность относительных электроотрицательностей связанных атомов (обозначим ее через Δχ), тем сильнее выражена полярность. Предельно высокое значение Δχ в соединении CsF (4,0 – 0,86 = 3,14). Итак, химическая связь между атомами ионная если Δχ ≈ 2; при Δχ = 0 - эта связь неполярная ковалентная; в промежуточных случаях – полярная ковалентная. В действительности связи не бывают ионными на 100 %. Поэтому говорят о степени, или доле ионности связи. Ее определяют опытным путем. Оказывается, даже в таком соединении, как CsF, ионная связь выражена только на 89 %.
Ионная связь в отличие от ковалентной связи характеризуется ненаправленностью в пространстве и ненасыщаемостью. Ненаправленность связи определяется тем, что каждый ион, представляющий собой как бы заряженный шар, может притягивать ион противоположного знака по любому направлению. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей: способность притягивать ионы противоположного знака у них остается по другим направлениям (ненасыщаемость).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 302; Нарушение авторских прав?; Мы поможем в написании вашей работы!