
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные процессы
|
|
|
|
Окислительно-восстановительные процессы (ОВП) играют важную роль в жизнедеятельности организма, поскольку именно в процессах окисления происходит выделение и запас энергии, а восстановительные процессы связаны с биосинтезом белков, нуклеиновых кислот, полисахаридов в организме. Окислительно-восстановительные реакции – это реакции, идущие с переносом электронов и изменением степени окисления элементов.
ОВП состоят из двух одновременно протекающих и противоположно направленных процессов - окисления и восстановления. Окисление – это процесс отдачи электронов, в ходе которого происходит увеличение степени окисления элементов. Восстановление - это процесс присоединения электронов, в ходе которого происходит уменьшение степени окисления элементов. Окислитель – это вещество, атом которого принимает электроны, тем самым уменьшая степень окисления. Восстановитель – это вещество, атом которого отдает электроны, тем самым увеличивая степень окисления. ОВП подразделяются на три типа.
1. Межмолекулярные, в которых окислитель и восстановитель находятся в разных молекулах, например:
2KMn+7O4 + 5KN+3O2 + 3H2SO4 = 2Mn+2SO4 + 5KN+5O3 + K2SO4 + 3H2O
окислитель - Mn+7, восстановитель - N+3.
2. Внутримолекулярные, в которых окислитель и восстановитель находятся в одной молекуле, но являются разными элементами, например:
2KCl+5O3-2 = 2KCl-1 + 3O40
окислитель - Cl+5, восстановитель - O-2.
3. Диспропорционирования (самоокисления - самовосстановления), в которых окислителем является один и тот же элемент в одной и той же степени окисления, например:
3Cl20 + 6KOH = 5КСl-1 + KCl+5O3 + 3H2O
окислитель - Cl0, восстановитель - Cl0.
В ходе окислительно-восстановительных процессов между частями системы происходит перераспределение зарядов. Возникающая разность зарядов между частями системы носит название потенциал. Существует несколько видов потенциалов, связанных с прохождением различных процессов.
Одним из них является электродный потенциал, который возникает в том случае, когда пластинку металла погружают в раствор его соли (например, пластинку цинка в раствор сульфата цинка). При этом возможно прохождение двух процессов, которые определяются активностью металла и концентраций его катиона в растворе (рис.1).
 Ме Ме
Ме Ме
 |  |
 + _ + _ _
+ _ + _ _

 Меn+ + _ + Меn+ _ + _
Меn+ + _ + Меn+ _ + _
 + _ + _ + _
+ _ + _ + _
+ + + _ + _


рис. 1 Виды электродных процессов
Первый процесс происходит в том случае, когда активность металла высока, а концентрация его катиона невелика. В этом случае (см. рис. 1) ионы металла, находящиеся в узлах кристаллической решетки металла, вследствие гидратации будут переходить в раствор, заряжая его положительно; электроны, входящие в состав «электронного газа» (особенности металлической связи) остаются на куске металла, придавая ему отрицательный заряд. В случае низкой активности металла и высокой концентрации его катиона процесс может идти в другом направлении (см. рис. 2). Катионы металла могут перейти на пластинку, достраивая кристаллическую решетку металла и придавая ей положительный заряд; анионы соли остаются в растворе, заряжая его отрицательно. В обоих процессах между пластинкой металла и раствором его соли возникает разность зарядов, называемая электродным потенциалом Е. Независимо от механизма возникновения электродного потенциала, он определяется окислительно-восстановительным процессом, а его величина - уравнением Нернста:



 Me Men+ + ne-
Me Men+ + ne-
 Zn Zn2+ + 2e-
Zn Zn2+ + 2e-
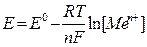
:
где: Е - потенциал системы,
Е0 - стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
Т - абсолютная температура,
n - число электронов, участвующих в процессе,
R = 8,31 Дж/моль * К,
Т = 96500 Кл/моль
[Меп+]- равновесная концентрация соли данного металла.
Подставляя постоянные при 25 0С, получим:

По величине стандартного электродного потенциала все металлы выстраиваются в электрохимический ряд напряжений.
Одним из основных является окислительно-восстановительный потенциал. Его возникновение связано с обратимостью окислительно-восстановительных процессов. Одно и то же вещество в зависимости от условий может находиться либо в окисленной (Oх), либо восстановленной (Red) форме. Между этими двумя формами идут процессы взаимного перехода, сопровождающиеся изменением заряда системы. Процесс взаимного перехода идет до тех пор, пока между двумя формами не установится равновесие:
 Red Ox + ne
Red Ox + ne
_

 Fe2+ Fe3+ + e
Fe2+ Fe3+ + e
После установления равновесия в системе возникает избыточный заряд, называемый окислительно-восстановительным или редокс-потенциалом. Его величина определяется уравнением Нернста:

где: Е - потенциал системы,
Е0 - стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
[Red], [Ох] - равновесные концентрации восстановленной и окисленной форм.
Любой окислительно-восстановительный процесс можно представить как взаимодействие двух редокс-систем - системы окислителя и системы восстановителя. Направление ОВП будет определяться величинами редокспотенциалов систем. При этом можно выделить следующие закономерности:
1. одна и та же редокс-система может являться как окислителем, так и восстановителем - это зависит от соотношения величин потенциалов;
2. системы с более отрицательным потенциалом будут восстанавливать системы с более положительным потенциалом;
3. после прохождения ОВП потенциалы редокс-систем выравниваются.
Возникновение разности зарядов между частями системы может быть и не связано с прохождением ОВП. Так, в ходе процесса диффузии между частями раствора, вследствие различной подвижности ионов, возникает разность зарядов, называемая диффузным потенциалом. Диффузный потенциал существует недолго и исчезает по окончании процесса диффузии.
Если два раствора разделить полупроницаемой мембраной, то на сторонах мембраны возникает разность зарядов, называемая мембранным потенциалом. Возникновение мембранного потенциала связано с тем, что вследствие различного размера ионов они могут проходить или не проходить через мембрану.
В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокспотенциалами. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделение и запасание энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 996; Нарушение авторских прав?; Мы поможем в написании вашей работы!