
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Таким образом, «зеленый пояс» Земли и карбонатная
|
|
|
|
система океана поддерживают относительно постоянное содержание СO2 в атмосфере.
Полагают, что до наступления индустриальной эры потоки
углерода между, атмосферой, материками и океанами были
сбалансированы.
Влияние человека на круговорот углерода проявилось в том, что с развитием индустрии и сельского хозяйства поступление СO2 в атмосферу стало расти за счет антропогенных источников.

Рис. 5.4. Биотический круговорот углерода
Основная масса углерода находится в земной коре в связанном состоянии. Важнейшие минералы углерода - карбонаты, количество углерода в них оценивается в 9,61015 т. Разведенные запасы горючих ископаемых (угли, нефть, битумы, торф, сланцы, газы) содержат около 1.103 углерода.
Главная причина увеличения содержания СО в атмосфере - это сжигание горючих ископаемых, однако свои вклад вносят и транспорт, и уничтожение лесов Сельское хозяйство также приводит к потере углерода в почве, так как фиксация CO2 из атмосферы агрокультурами в течение лишь чести года не компенсирует полностью высвобождающийся из почвы углерод, которые теряется при окислении гумуса (результат частой вспашки).
При уничтожении лесов содержание углекислого газа в атмосфере увеличивается при непосредственном сжигании древесины, за счет снижения фотосинтеза и при окислении гумуса почвы (если на месте лесов распахивают поля или строят города). Леса - важные накопители углерода: в биомассе лесов приблизительно в 1,5, а в лесном гумусе - в 4 раза больше углерода, чем в атмосфере.
Современное изменение ландшафта человеком заметно повлияло на поток углерода из резервного фонда в обменный. Можно представить, какое огромное количество С02 выделится, если будет сожжена хотя бы половина фонда горючих ископаемых. Одновременное уменьшение поглотительной способности «зеленого пояса» может привести к сбою механизмов саморегуляции и природного контроля. Содержание СO2 в атмосфере уже сейчас начинает возрастать. В начале промышленной революции, примерно в 1800 г., в атмосфере Земли содержалось около 290 частей СO2 на миллион (0,029 %). В 1958 г. содержание СO2 составляло 0,0315 %, а в 1980 г. выросло до 0,0335 %. Если содержание углекислого газа в атмосфере вдвое превысит доиндустриальный уровень (приблизится к 0,06 %), что может произойти в конце следующего столетия, то вероятно потепление климата на 1,5 -4,5 °С. Наряду с подъемом уровня моря (в этом веке он уже
|
|
|
поднялся примерно на 12 см) и перераспределением осадков, эти изменения могут привести к затоплению прибрежных районов. Так называемые проблемы С02 («парниковый эффект») должны учитываться при планировании национальной и международной энергетической и экономической политики. Правда, предполагают, что в следующем веке может установиться новое (но ненадежное) равновесие между увеличением количества СO2 и запыленностью атмосферы частицами, отражающими тепловое излучение. Но любое результирующее изменение теплового бюджета Земли все равно повлияет на климат.
Кроме СO2, в атмосфере присутствуют в небольших количествах еще два углеродных соединения: оксид углерода СО (около 0,1 млн-1) и метан СН4 (около 1,6 млн-1). Как и СO2, они находятся в быстром круговороте: время пребывания в атмосфере СО - около 0,1 года, для СН4 - 3,6 года, а для СO2 - 4 года. В естественных условиях СО и СН4 образуются при неполном анаэробном разложении органических веществ и в атмосфере окисляются до СO2. Количество СО, попадающего в атмосферу при сгорании топлива, особенно с выхлопными газами, равно его естественному поступлению.
Оксид углерода - смертельный яд для человека. В глобальном масштабе его количество не представляет угрозы, но, в городах концентрация этого газа достигает 100 млн1, т. е. в 1000 раз больше естественного содержания, и становится угрожающей, особенно в районах с сильным автомобильным движением. Для сравнения приведем такие данные: курильщик (пачка сигарет в день) получает столько СО, сколько он получил бы, дыша воздухом с содержанием СО 400 млн -1. Это уменьшает содержание оксигемоглобина в его крови на 3 % и приводит к анемии и другим заболеваниям, связанным с гипоксией (гр. hypo - низкое, охi - кислород): ишемической болезни, стенокардии, другим сердечно-сосудистым заболеваниям. Следовательно, вдыхание СО в насыщенных автотранспортом городах сопоставимо с его количеством, поступающим в кровь при курении табака.
|
|
|
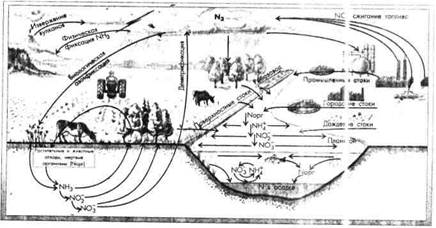
Круговорот азота. Воздух по объему почти на 80 % состоит из молекулярного азота N2 и представляет собой крупнейший резервуар этого элемента.
Поступление азота в атмосферу происходит: 1) в процессе денитрификации, т. е. биохимического восстановления оксидов азота до молекулярного газа N2; 2) с вулканическими газами и 3) с «индустриальными вулканами» (дымом, выхлопными газами). В водоемы соединения азота поступают: с поверхностным и дренажным стоком с городских и сельских территорий; с подземными водами; с городскими и промышленными стоками; со сточными водами сельскохозяйственных производств.
Поглощение азота из воздуха происходит: 1) в процессе азотфиксации благодаря деятельности азотфиксирующих бактерий и многих водорослей (прежде всего синезеленых), 2) в результате естественных физических процессов фиксации азота в атмосфере (электрические разряды при грозе и др.) и 3) в процессе промышленного синтеза NH3.
Минеральные соединения азота (NH4+, NO2, NO3) потребляются растениями при фотосинтезе. Животные, поедая растения, используют азот для построения белков протоплазмы, превращая его в органические формы (рис. 5.5.)
|
| Рис. 5. Биотический круговорот аазота |
Биотический круговорот азота включает ряд очень сложных процессов, основную роль в которых играют микроорганизмы.
Проиллюстрировать эти процессы можно на примере распада наиболее сложных высокомолекулярных азотсодержащих органических веществ - белков. Распад белков идет в несколько стадий. На первой стадии происходит расщепление белков до аминокислот микроорганизмами, вырабатывающими ферменты протеазы:
|
|
|
БЕЛКИ Þ ПЕПТОНЫ ÞПОЛИПЕПТИДЫÞАМИНОКИСЛОТЫ.
На второй стадии аминокислоты (RCHNH2COOH) разлагаются бактериями, актиномицетами, грибами как в аэробных, так и в анаэробных условиях:
RCHNH2COOH + 02 Þ RCOOH + NH3 +C02
RCHNH2COOH + Н20 -> RCHOHCOOH + NH3
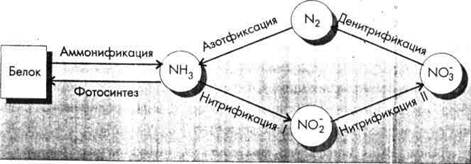
Поскольку продуктом разложения аминокислот независимо от путей расщепления является аммиак NH3, то эта стадия называется аммонификацией.
В результате белкового обмена в животных организмах выделяется мочевина CO(NH2)2, которая тоже служит источником NH3:
CO (NH2)2 + Н20 Þ 2NH3 + С02.
При аммонификации могут образовываться также сероводород H2S, индол C2H7N, скатол C9H9N, этилмеркаптан C2H5SH. Все эти вещества обладают неприятным резким запахом, поэтому распад белков часто называют гниением.
Далее, выделившийся аммиак в природных условиях частично используется растениями как питательный материал, а частично окисляется, взаимодействуя с кислородом. Эта стадия превращений азота называется нитрификацией и протекает в две фазы в процессе жизнедеятельности нитрифицирующих бактерий. В первой фазе аммиак окисляется до азотистой кислоты (или нитритов):
2NH3 + 3O2 Þ 2HNO2 + 2Н2O + Q1,
во второй фазе азотистая кислота окисляется до азотной (или до нитратов):
2HNO2 + O2 Þ2HNO3 + Q2
Нитрификация в первой фазе осуществляется в основном нитрификаторами из рода Nitrozomonas, а во второй - из рода Nitrobacter. В изучение этого процесса большой вклад внес русский микробиолог С. Н. Виноградский (1856 1932). Один из, возбудителей нитрификации нос it его имя - Nitrobacter Winogradsky. Он открыл также некоторые азот фиксирующие бактерии. Реакции нитрификации идут с выделением энергии, которую бактерии используют для своей жизнедеятельности, т. е. они являются хемоавтотрофами.
Образовавшиеся при нитрификации нитриты и нитраты могут быть потенциальным источником кислорода в анаэробных условиях.
|
|
|
Безазотистые органические вещества окисляются за счет нитритов и нитратов. При этом нитриты и нитраты восстанавливаются до газообразного азота, вновь поступающего в атмосферу. Этот процесс называется денитрификацией:
5Сорг + 4KNO3 Þ 2К2СО3+ 3СO2 + 2N2
Денитрификация протекает с потреблением энергии за счет жизнедеятельности бактерий, в основном, из рода Pseudomonas и Micrococcus.
В сточных водах, особенно при биологической очистке, в процессе нитрификации часто образуются излишнее количества нитритов и нитратов, которые могут вызывать нежелательное «цветение» воды в водоемах. Поэтому процессы денитрификации используются для глубокой доочистки сточных вод от минеральных форм азота. В данном случае человек стремится возвратить в круговорот излишки азота, образующиеся при принудительной разложении органических веществ на очистных сооружениях.
Азотфиксация (связывание молекулярного азота) - процесс, обратный денитрификации. Оба процесса требуют энергии, которую микроорганизмы получают либо в виде солнечного света, либо в виде органического вещества.
Долгое время считалось, что фиксировать N2 атмосферы могут немногие, но широко распространенные в природе микроорганизмы, а именно: бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений - Rhizobium, синезеленые водоросли Anabaena, Nostoc и др. Затем было обнаружено, что многие водные и почвенные бактерии также обладают этой способностью, Кроме того, оказалось, что примитивные грибы (актиномицеты) в клубеньках ольхи и некоторых других деревьев (около 160 видов) фиксируют N2 не менее эффективно. В отличие от бобовых, эти фиксаторы приспособлены к бедным песчаным или болотистым почвам, где доступного для растений азота мало. Поэтому ольха, например, может увеличивать продукцию деловой древесины, если ее сажать вместе с ценными породами деревьев. Биологическая фиксация азота идет в автотрофном и гетеротрофном ярусах экосистем, в аэробных и анаэробных зонах.
Anabaena, Nostoc и др. Затем было обнаружено, что многие водные и почвенные бактерии также обладают этой способностью, Кроме того, оказалось, что примитивные грибы (актиномицеты) в клубеньках ольхи и некоторых других деревьев (около 160 видов) фиксируют N2 не менее эффективно. В отличие от бобовых, эти фиксаторы приспособлены к бедным песчаным или болотистым почвам, где доступного для растений азота мало. Поэтому ольха, например, может увеличивать продукцию деловой древесины, если ее сажать вместе с ценными породами деревьев. Биологическая фиксация азота идет в автотрофном и гетеротрофном ярусах экосистем, в аэробных и анаэробных зонах.
Но большинство наземных растений и высших водорослей, несмотря на огромное количество азота в атмосфере, способны усваивать «то лишь в виде ионов, т. е. в виде NH4+, N02- или N03-.
Итак, только примитивные микроорганизмы могут превращать биологически бесполезный газообразный азот в формы, усвояемые растениями. Они образуют взаимовыгодные ассоциации с высшими растениями, усиливающие фиксацию азота. Растения предоставляют бактериям «квартиры» (корневые клубеньки), защищают от избытка кислорода и поставляют необходимую энергию (органические вещества). За это растения получают азот в доступной для них форме. Для расщепления N2 бактериям необходимо много энергии на разрыв тройной связи. Бактерии в клубеньках бобовых расходуют на фиксацию 1 г атмосферного азота около 10 г глюкозы (примерно 40 ккал), синтезируемой растением на свету. При промышленной фиксации N2 (получение NH3) также расходуется много энергии горючих ископаемых, поэтому азотные удобрения стоят дороже любых других. Таким образом, центральное место в биотической циркуляции азота занимает NH3 (рис. 5.6).
|
Рис. 5.6. Схема превращений азота в биотическом круговороте
Влияние человека на круговорот азота достаточно велико. Он выращивает на обширных площадях бобовые растения, а также промышленным способом связывает азот.
Подсчитано, что сельское хозяйство и промышленность дают почти на 60 % больше фиксированного азота, чем естественные наземные экосистемы. В этом случае люди пытаются копировать природную стратегию взаимовыгодного сотрудничества, способствующую выживанию. Если бы специалистам по генной инженерии удалось индуцировать образование клубеньков у пшеницы, кукурузы, риса и других пищевых культур, это помогло 6.1 сэкономить немало средств и энергии, избавило бы от необходимости внесения азотных удобрений. Хороших результатов можно достигнуть и сейчас, если лучше использовать бобовые в сельском хозяйстве. Бобовые растения - природные фиксаторы азоте - работают активнее в среде с малым количеством азота, поэтому внесение азотных удобрений под бобовые не имеет смысла, так как выключает биофиксацию атмосферного N2. Из азота, поступившего с удобрениями, очень небольшая часть вовлекается в круговорот повторно. Большая доля его теряется: выносится с водой, с урожаем и в процессе денитрификации. В США, например, количество используемых азотных удобрений с 1950 г. возросло в 12 раз, а урожай - не более чем в 2 раза. Кроме того, избыток нитратов в пище и воде может быть опасен для людей. Напрасной траты азота и энергии можно избежать, если рационально чередовать зерновые и бобовые культуры в севообороте.
Ежегодно в глобальном круговороте биотическим сообществом усваивается около 109 т азота. При этом 80 % его поступает с суши и воды и лишь около 20 % добавляется «нового» азота из атмосферы.
В масштабе биосферы, благодаря механизмам обратной связи и большому резервному фонду, круговорот азота относительно совершенен. Хотя часть азота из густонаселенных областей уходит в глубоководные океанические отложения и выключается из круговорота, возможно, на миллионы лет - эта потеря в какой-то мере компенсируется поступлением его в воздух с вулканическими газами, Следовательно, извержения вулканов нельзя считать только вредными. Если бы вдруг удалось заблокировать все вулканы на Земле, то можно предположить, что от голода страдало бы не меньше людей, чем сейчас страдает от их извержений.
Антропогенная денитрификация (удаление избыточных нитритов и нитратов) и стремление к сокращению производства нитратных удобрений соответствуют природным процессам и способствуют сохранению цикличности движения азота.
В последнее время содержание N2 в атмосфере не менялось. Можно думать, что поступление его в атмосферу (денитрификация) и отток из атмосферы (азотфиксация) в целом уравновешены, хотя, возможно, фиксация слегка преобладает вследствие деятельности человека.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1812; Нарушение авторских прав?; Мы поможем в написании вашей работы!