
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Протонно-нейтронная структура ядра
Атом состоит из ядра и электронной оболочки. Размер атома определяется электронной оболочкой и равен ≈ 10-8 см. Ядро – центральная массивная часть атома, расположено в центре атома и имеет размеры ≈ 10-13 ¸ 1012 см (1 – 10 Фм (ферми)). Следовательно, размер ядра меньше атома в 104 – 105 раз.
Ядро состоитиз особых частиц - протонов и нейтронов. Протон имеет один элементарный положительный электрический заряд, а электрический заряд нейтрона равен нулю. Между этими частицами в любых парных комбинациях действуют особые (ядерные) силы, не зависящие от их электрического заряда, которые обеспечивают связь отдельных частиц с ядром. Поэтому в ядерной физике используют обобщающий термин нуклон, обозначающий любую из частиц, входящую в состав ядра, - как протон, так и нейтрон.
Число нуклонов в ядре называется массовым числом и обозначается буквой А. Массовое число – всегда целое число.
Число протонов в ядре обозначается буквой Z. Кроме этого Z – число электронов в атоме с ядром, имеющим Z протонов, поскольку атом является электрически нейтральным. Так как химические свойства элементов определяются числом электронов в атоме, то Z есть также порядковый номер или атомный номер элемента в таблице Менделеева.
Число нейтронов в ядре обозначают буквой N. Следовательно, число нейтронов в ядре N = A – Z.
Любая из трех пар чисел (Z,N), (N,A) или (A,Z) однозначно определяет состав ядра. Обычно, по причинам, которые будут указаны ниже, используют пару чисел (А,Z).
Атомы, ядра которых имеют конкретные значения А и Z, называются нуклидами. Для обозначения нуклида используют две формы записи: (А,Z) или 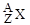 , где Х - символ химического элемента, атомы которого имеют соответствующее ядро. Например, (12,6) или
, где Х - символ химического элемента, атомы которого имеют соответствующее ядро. Например, (12,6) или 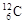 - соответствующий нуклид углерода. Поскольку символ химического элемента однозначно связан с Z, то часто атомный номер в форме записи с указанием символа химического элемента опускают и пишут просто
- соответствующий нуклид углерода. Поскольку символ химического элемента однозначно связан с Z, то часто атомный номер в форме записи с указанием символа химического элемента опускают и пишут просто 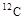 . Такие же обозначения используются и для ядер.
. Такие же обозначения используются и для ядер.
Атомы, ядра которых имеют в своем составе одинаковое число протонов Z, но различающиеся числом нуклонов А, называются изотопами химического элемента. Вещества, имеющие в своем составе атомы изотопов, имеют одинаковые химические свойства, но различную плотность, температуру плавления, кипения и пр., т.е. различаются физическими свойствами. Например: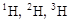 изотопы водорода. 1Н - Протий (легкий водород); 1Н - дейтерий (тяжелый водород, употребляют также символ
изотопы водорода. 1Н - Протий (легкий водород); 1Н - дейтерий (тяжелый водород, употребляют также символ 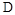 , для ядра - d); 3Н - тритий (сверхтяжелый водород, употребляют также символ
, для ядра - d); 3Н - тритий (сверхтяжелый водород, употребляют также символ 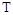 , для ядра d). 233U, 235U, 238U - изотопы урана. Однако об изотопе имеет смысл говорить, подразумевая его принадлежность к химическому элементу. Поэтому 235U- делящийся нуклид урана, а не делящийся изотоп урана. Таким же образом 3Н - радиоактивный нуклид водорода, а не радиоактивный изотоп, так как и в этом случае подразумеваются физические характеристики ядра, а не соответствующие химические свойства атома.
, для ядра d). 233U, 235U, 238U - изотопы урана. Однако об изотопе имеет смысл говорить, подразумевая его принадлежность к химическому элементу. Поэтому 235U- делящийся нуклид урана, а не делящийся изотоп урана. Таким же образом 3Н - радиоактивный нуклид водорода, а не радиоактивный изотоп, так как и в этом случае подразумеваются физические характеристики ядра, а не соответствующие химические свойства атома.
Нуклиды, ядра которых имеют одинаковое число нуклонов (одинаковое массовое число А), но различное число протонов Z, называют изобарами. Например: 3Н и 3Не - изобары трития и гелия, 10Ве, 10В, 10С - изобары бериллия, бора и углерода.
Нуклиды с одинаковым числом нейтронов в составе ядра называют изотонами. Например, 2Н и 3Не - изотоны водорода и гелия.
Свойства ядер различных нуклидов можно систематизировать с помощью протонно-нейтронной диаграммы – таблицы, строки которой соответствуют нуклидам с одинаковым числом протонов, а столбцы – нуклидам с одинаковым числом нейтронов. На рис.1.1.1 показан принцип построения протонно-нейтронной диаграммы на примере нуклидов с легкими ядрами. Протонно-нейтронная диаграмма для всех известных нуклидов приведена на рис.1.1.2.
Отметим следующие эмпирические факты и закономерности, которые следуют из протонно-нейтронной диаграммы атомных ядер.
 1. Известно 265 стабильных нуклидов, нестабильных нуклидов значительно больше, около 1700.
1. Известно 265 стабильных нуклидов, нестабильных нуклидов значительно больше, около 1700.
2. Известны нуклиды со всеми значениями Z от 0 (нейтрон) до 108. Для существующих в природе ядер Z меняется от 1 (водород) до 92 (уран). Остальные нуклиды получают искусственно. Не существует стабильных нуклидов с Z = 0, 43, 61 и Z ³ 84.
3. Известны нуклиды с числом нуклонов А от 1 до 263 включительно. Не существует стабильных нуклидов при А =5, 8 и при А ³ 210.
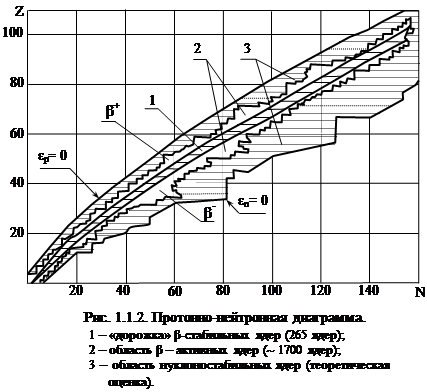 4. Область нейтронной диаграмы, где располагаются β‑стабильные нуклиды (заштрихованная полоса 1 на рис.1.1.2), называется дорожкой стабильности. Легкие стабильные нуклиды (до Z ≤ 20) содержат в составе ядра примерно равное число протонов и нейтронов. При увеличении А относительная доля нейтронов возрастает. Например, у легкого нуклида
4. Область нейтронной диаграмы, где располагаются β‑стабильные нуклиды (заштрихованная полоса 1 на рис.1.1.2), называется дорожкой стабильности. Легкие стабильные нуклиды (до Z ≤ 20) содержат в составе ядра примерно равное число протонов и нейтронов. При увеличении А относительная доля нейтронов возрастает. Например, у легкого нуклида 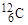 N/Z = 1; у среднего нуклида
N/Z = 1; у среднего нуклида
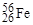 N/Z = 1,15; у тяжелого нуклида
N/Z = 1,15; у тяжелого нуклида 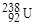 N/Z = 1,59. Опережающий рост числа нейтрона при больших А вызван действием дальнодействующих кулоновских сил отталкивания протонов в ядре.
N/Z = 1,59. Опережающий рост числа нейтрона при больших А вызван действием дальнодействующих кулоновских сил отталкивания протонов в ядре.
5. Большинство химических элементов имеетпо несколько стабильных иb-активных нуклидов. Некоторые элементы имеют (см. рис.1.1.1) всего по одному стабильному нуклиду (9Be, 19F, 23Na), остальные - по 2 - 3 стабильных нуклидов. Олово (Sn) имеет десять стабильных нуклидов.
6. Выше дорожки стабильности располагаются β+‑активные нуклиды, ниже – 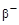 ‑активные нуклиды.
‑активные нуклиды.
7. Свойства ядер существенно зависят от четности чисел Z и N. Наибольшее число стабильных нуклидов (155 из 265) имеют четно-четные ядра (Z – четно, N – четно), поровну стабильных нуклидов (по 53) с четно-нечетным и нечетно-четным количеством нуклонов в составе ядер. И имеется всего четыре стабильных нуклида (2Н, 6Li, 10В и 14N), имеющих нечетно-нечетный состав ядер.
|
|
Дата добавления: 2014-01-04; Просмотров: 737; Нарушение авторских прав?; Мы поможем в написании вашей работы!