
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електричний струм у розчинах і розплавах електролітів. Закони електролізу. Застосування електролізу
|
|
|
|
Розподіл висот на Землі.
Л. Кінг відмічає, що середні висоти континентів знаходяться в чіткій залежності від їх відносних площ.
| Материк | Площа, млн.км2 | Середня висота над рівнем моря, м |
| Австралія | 7,63 | |
| Європа | 10,0 | |
| Південна Америка | 17,83 | |
| Північна Америка | 24,25 | |
| Африка | 30,32 | |
| Азія | 43,44 | |
| Антарктида | 14,11 | 2040[*] |
Розподіл і коливання висот земної поверхні зумовлено насамперед формою планети та її тектоорогеннією.
Різниця висот поверхні Землі досягає близько 20 км
8848 м (Еверест)
11022 м (Маріанська западина)
19870 м
Отже, коливання висот земного еліпсоїда обертання лежить в межах різниці довжини його великої і малої півосей (21382 м). Максимальні коливання висот поверхні Землі зосереджені саме в області максимального розтягнення еліпсоїда. Глибина прогинів його поверхні теоретично можлива до поверхні кулі, вписаної в еліпсоїд в екваторіальній зоні, приблизно до 20 км від поверхні геоїда. Від екватора до полюсів поверхня Землі сплющується. Найбільш значні коливання висот спостерігаються між 10°. Найбільше розчленована поверхня Землі в Східній півкулі між 120 і 160 меридіанами і 40 паралелями на північ і південь від екватора. У західній півкулі аналогічні коливання висот спостерігаються між 60 і 80 меридіанами і між 20°-30° на північ і південь від екватора. Розчленована поверхня Землі створює сприятливі умови для гравітаційного переміщення мінеральних мас.
В океанах залежність глибини від площ така:
| Тихий океан | 178,68 млн. кв. км | середня глибина 3976 м |
| Атлантичний | 91,66 | |
| Індійський | 76,17 | |
| Північний Льодовитий | 14,75 | |
| Світовий океан | 361,26 |
Середній рівень земної поверхні +245 м.
Середній рівень земної кори -2440 м.
ЛІТЕРАТУРА
1. Волошин І.І. Дослідження Землі із космосу (космічне землезнавство). - К.: КНПУ ім. М.П.Драгоманова, 2003.
2. Леонтьев О.К., Рыгачов Г.И. Общая геоморфология. 1988. Гл. 8-10.
3. Монин А.С. История Земли. – Ленинград: Наука, 1977. Гл. 6, 10.
4. Якушко О.Ф. Основы геоморфологии. – Минск: Вышейшая школа, 1986. Гл. 10.
[*] Висота крижаної поверхні
Рідини, як і тверді тіла, можуть бути діелектриками, провідниками і напівпровідниками. Діелектриком є також дистильована вода. До провідників належать розплави і розчини електролітів: кислот, лугів і солей. Рідкими напівпровідниками є розплавлений селен, розплави сульфідів та ін.
Під час розчинення електролітів під впливом електричного поля полярних молекул води відбувається розпад молекул електролітів на іони. Цей процес називають електролітичною дисоціацією, в результаті якої нейтральні молекули розпадаються на позитивні та негативні іони. В електроліті з'являються вільні носії зарядів і він починає проводити струм. Оскільки заряд у водних розчинах чи розплавах електролітів переноситься іонами, то таку провідність називають іонною.
За іонної провідності проходження струму пов'язано із перенесенням речовини. На електродах відбувається виділення речовин, які входять до складу електроліту. На аноді негативно заряджені частинки віддають свої зайві електрони (окислювальна реакція), а на катоді позитивні іони отримують електрони (реакція відновлення). Процес виділення на електроді речовини, пов'язаний із окиснювально-відновлювальними реакціями, називають електролізом.
Розглянемо явище електролізу на прикладі мідного купоросу. В результаті електролітичної дисоціації CuSO4 = Cu2 + + SO42 +. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 4.3.4). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.

Нехай за час t через електроліт буде перенесено заряд. Кількість іонів, які досягли електрода, дорівнюватиме:
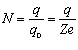 ,
,
де q 0 = Ze - заряд іона; Z - валентність іона; e - елементарний заряд.
Кількість іонів N дорівнює кількості атомів речовини, що виділиться на електроді, а маса виділеної речовини
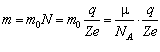 , (4.3.3)
, (4.3.3)
де m 0 - маса одного атома,
 ; m - молярна маса речовини.
; m - молярна маса речовини.
Для кожного хімічного елемента можна у виразі (4.3.3) виділити сталу величину k, яку називають електрохімічним еквівалентом речовини:
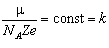 . (4.3.4)
. (4.3.4)
У СІ електрохімічний еквівалент вимірюють у кілограмах на кулон:
[ k ] = кг/Кл.
Виходячи з цього можна записати, що
m = kq = kI D t. (4.3.5)
Маса речовини, яка виділяється на катоді за час D t, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Електрохімічний еквівалент речовини визначено для всіх хімічних елементів. Він є табличною величиною, але його не важко розрахувати:
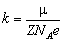 , де
, де
 - хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
- хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
F = NAe = 6,02·1023 1/моль ×1,6·10-19 Кл = 96500 Кл/моль.
Стала Фарадея дорівнює заряду, під час перенесення якого одновалентними іонами через розчин або розплав електроліту виділяється 1 моль речовини.
З цих міркувань вираз (4.3.4) набуде вигляду:
 . (4.3.6)
. (4.3.6)
Формула (4.3.6) виражає другий закон Фарадея для електролізу: електрохімічні еквіваленти різних речовин прямо пропорційні їх хімічним еквівалентам. Якщо у вираз (4.3.5) підставити співвідношення (4.3.4), то отримаємо
об'єднаний закон Фарадея для електролізу:
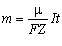 .
.
Явище електролізу має широке застосування в електрометалургії (добування чистих металів); у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1017; Нарушение авторских прав?; Мы поможем в написании вашей работы!