
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принципы построения электронной структуры атомов элементов
|
|
|
|
Строение многоэлектронных атомов.
В многоэлектронных атомах, как и в атоме водорода, состояние каждого электрона можно характеризовать квантовыми числами n, l, ml, mS. Межэлектронное отталкивание приводит к тому, что энергия электронов, имеющих одно и тоже значение n, но разные значения l, становится различной. Последовательность заполнения электронами подуровней в многоэлектронных атомах определяется принципом наименьшей энергии, принципом Паули и правилом Хунда.
Принцип наименьшей энергии гласит: заполнение электронами АО происходит в порядке возрастания их энергии. На основании изучения спектров атомов и квантово-механических расчетов установлена энергетическая диаграмма (рис.3) для различных АО в многоэлектронных нейтральных атомах, находящихся в основном состоянии (состоянии с наименьшей энергией).
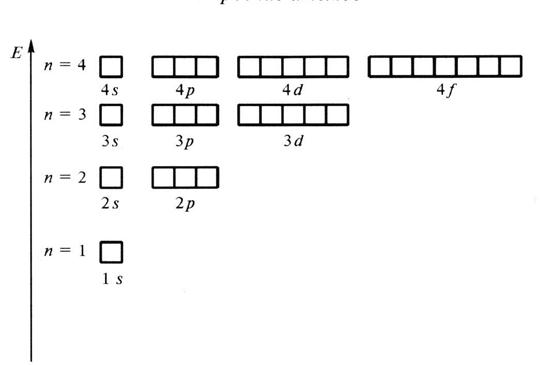
Рис. 3. Энергетическая диаграмма атома водорода.
Последовательность АО в порядке возрастания их энергии имеет вид
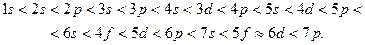
Порядок возрастания энергии АО в сложных атомах описывается правилом (n + l) (или правилом Клечковского):
энергия АО возрастает в соответствии с увеличением суммы n+l главного и орбитального квантовых чисел. При одинаковом значении суммы, энергии меньше у АО с меньшим значением главного квантового числа.
Согласно принципу Паули, в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел. Каждый электрон в атоме имеет свой набор четырех квантовых чисел, который полностью определяет энергетическое состояние электрона. Так, для АО-1 s существует два набора квантовых чисел:
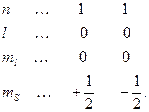
Таблица 4
Сумма значений главного и орбитального квантовых чисел
| Энергетический уровень n | Энергетический подуровень | n + l | |
| l | Обозначение подуровня | ||
| 1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f 5 s 5 p 5 d 5 f 5 g |
Следовательно, на s -АО может находиться только два электрона с различными значениями спинового квантового числа.
Для каждой из трех 2р -АО также возможно только два набора квантовых чисел. Например, для одной из 2р -АО:
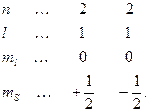
Значит, на р -подуровне любого уровня может находиться шесть электронов.
Таким образом, на одной орбитали могут находиться только два электрона с противоположными по знаку значениями спинового квантового числа. Два электрона, находящиеся на одной орбитали, то есть имеющие одинаковые значения квантовых чисел n, l, ml, но различные значения спинового квантового числа mS, называют спаренными. Принцип определения максимального числа электронов, которые могут находиться на уровне с главным квантовым числом, показан в табл.5.
Общее число орбиталей на энергетическом уровне со значение главного квантового числа n равно n 2. Так как на одной орбитали может находиться лишь два электрона, получаем, что максимальная электронная емкость энергетического уровня составляет 2 n 2.
Правило Хунда определяет последовательность заполнения АО электронами в пределах одного подуровня и формулируется следующим образом:
при данном значении квантового числа l (то есть в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально.
Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
Таблица 5
Максимальное число электронов на первых четырех энергетических уровнях
| Энергетический уровень n | l | ml | mS | Число электронов | |
| на подуровне | на уровне | ||||
| 0 (s) 0 (s) 1 (p) 0 (s) 1 (p) 2 (d) 0 (s) 1 (p) 2 (d) 3 (f) | -1, 0, 1 -1, 0, 1 -2, -1, 0, 1, 2 -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 | ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 |
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 435; Нарушение авторских прав?; Мы поможем в написании вашей работы!