
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природа химической связи
|
|
|
|
Химическая связь образуется только в том случае, если при сближении атомов полная энергия системы (Екин.+Епот.) понижается.
Рассмотрим природу химической связи на примере молекулярного иона водорода H2+. (Он получается при облучении молекул водорода Н2 электронами; в газовом разряде). Для такой простейшей молекулярной системы наиболее точно решается уравнение Шредингера.
В ионе водорода Н2+ один электрон движется в поле двух ядер – протонов. Расстояние между ядрами равно 0,106 нм, энергия связи (диссоциация на атомы Н и ион Н+) составляет 255,7 кДж/моль. То есть частица прочная.
В молекулярном ионе Н2+ действуют электростатические силы двух типов – силы притяжения электрона к обоим ядрам и силы отталкивания между ядрами. Сила отталкивания проявляется между положительно заряженными ядрами НА+ и НА+, что можно представить в виде следующего рис. 3. Сила отталкивания 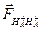
 стремится развести ядра друг от друга.
стремится развести ядра друг от друга.
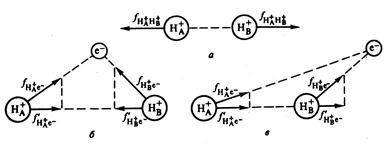
Рис. 3. Сила отталкивания (а) и притяжения (б) между двумя ядрами, возникающая при их сближении на расстояния порядка размеров атомов.
Силы притяжения действуют между отрицательно заряженным электроном е − и положительно заряженными ядрами Н+ и Н+. Молекула образуется в том случае, если равнодействующая сил притяжения и отталкивания равна нулю, то есть взаимное отталкивание ядер должно быть скомпенсировано притяжением электрона к ядрам. Такая компенсация зависит от расположения электрона е −относительно ядер (рис.3 б и в). Здесь имеется в виду не положение электрона в пространстве (что нельзя определить), а вероятность нахождения электрона в пространстве. Расположение электронной плотности в пространстве, соответствующий рис. 3.б) способствует сближению ядер, а соответствующее рис. 3.в) – расталкиванию ядер, так как в этом случае силы притяжения 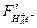 направлены в одну сторону и отталкивание ядер не компенсируется. Таким образом, имеется область связывания, когда электронная плотность распределена между ядрами и область разрыхления или антисвязывания, когда электронная плотность распределена за ядрами.
направлены в одну сторону и отталкивание ядер не компенсируется. Таким образом, имеется область связывания, когда электронная плотность распределена между ядрами и область разрыхления или антисвязывания, когда электронная плотность распределена за ядрами.
Если электрон попадает в область связывания, то химическая связь образуется. Если же электрон попадает в область разрыхления, то химическая связь не образуется.
В зависимости от характера распределения электронной плотности в области связывания различают три основных типа химической связи: ковалентную, ионную и металлическую. В чистом виде эти связи не имеют места, и обычно в соединениях присутствует комбинация этих типов связи.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 388; Нарушение авторских прав?; Мы поможем в написании вашей работы!