
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплота процесса не зависит от пути процесса, а определяется только начальным и конечным состояниями системы
Тепловые эффекты химических реакций
При химических превращениях освобождается часть содержащейся в веществах энергии. Измеряя количество теплоты, выделяющееся при реакции можно определить тепловой эффект реакции.
Любая химическая реакция сопровождается выделением или поглощением тепла, так как при химических реакциях происходит взаимное превращение внутренней энергии веществ. Реакции, протекающие с выделением тепла, называют экзотермическими, а реакции, при которых энергия поглощается эндотермическими. В экзотермической реакции теплота выделяется, что происходит за счёт уменьшения энтальпии (теплосодержания) системы, то есть ∆Н<0. В эндотермической реакции ∆Н>0.
Таким образом, тепловым эффектом химического процесса называется изменение энтальпии, произошедшее при осуществлении этого процесса. Тепловые эффекты химических реакций принято относить к одному молю образующегося вещества. Из первого закона термодинамики следует, что если при образовании какого-либо соединения выделяется или поглощается некоторое количество теплоты, то при разложении этого соединения в тех же условиях такое же количество теплоты поглощается или выделяется:
∆H (реакции образования) = - ∆H (реакции разложения).
Изменение энтальпии при образовании одного моля сложного вещества из элементов называется энтальпией образования данного соединения.
Тепловые эффекты включают в уравнение химических реакций. Химические уравнения, в которых указано изменение энтальпии, называется термохимическим уравнением. Изменение энтальпии указывается в правой части уравнения после запятой со знаком минус в случае экзотермической реакции и со знаком плюс в случае эндотермической реакции.
Из выражений
δQР = dН δQV = dU
можно сделать вывод, что теплота процесса приобретает свойство функции состояния, то есть она не зависит от пути процесса, а определяется только начальным и конечным состоянием системы. Данное утверждение называется законом Гесса.
Закон Гесса или закон постоянства сумм тепловых эффектов, сформулирован русским учёным Гессом (1840 г.) в следующем виде:
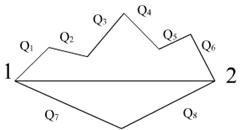
Q1+Q2+Q3+Q4+Q5+Q6 = Q7+Q8
Он является следствием I закона термодинамики.
Закон Гесса позволяет обращаться с термохимическими уравнениями, как с алгебраическими. Термохимические уравнения можно складывать друг с другом или вычитать, а также умножать на одно и тоже число.
Закон Гесса позволяет вычислить тепловой эффект любой реакции, если знать теплоты образования веществ или теплоты их сгорания.
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ принимается равной нулю.
Теплотой сгорания называется тепловой эффект (при постоянном давлении) реакции окисления кислородом одного моль химического соединения с образованием следующих продуктов реакции: CO2, SO2, H2O, N2.
Теплоты образования и теплоты сгорания большинства веществ известны из экспериментальных измерений в стандартных условиях. Их значения приводятся в справочниках.
Из закона Гесса вытекают два важных следствия.
1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ с учётом их стехиометрических коэффициентов
∆H = 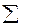 υпрод ∆Hобрпрод -
υпрод ∆Hобрпрод - 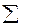 υисх ∆Hобрисх (17).
υисх ∆Hобрисх (17).
2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов реакции с учетом их стехиометрических коэффициентов:
∆H = 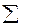 υисх ∆H сг исх -
υисх ∆H сг исх - 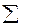 υпрод ∆Hсг прод (18).
υпрод ∆Hсг прод (18).
Поскольку тепловой эффект и энтальпия зависят от давления и температуры, то их относят к стандартному состоянию, которое определяется следующими параметрами:
Р = 101325 Па Т = 298 К при этом тепловой эффект может обозначаться следующими символами ∆H0298 или ∆H0.
|
|
Дата добавления: 2014-01-04; Просмотров: 1463; Нарушение авторских прав?; Мы поможем в написании вашей работы!