
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы кристаллизации
|
|
|
|
Для проведения процесса кристаллизации необходимо создать в растворе пересыщение. Пересыщение в растворе создается различными методами. Наибольшее распространение получили: охлаждение или, для некоторых веществ с отрицательной растворимостью, нагревание раствора; частичное удаление растворителя при выпаривании.
Метод, при котором меняют температуру раствора, называется изогидрической кристаллизацией. При этом количество растворителя остается постоянным. Рассмотрим этот процесс с охлаждением раствора на диаграмме растворимости (Рис. 5). Точка А на диаграмме соответствует раствору в начальный момент времени. В этой точке ненасыщенный раствор имеет температуру T1 и концентрацию С1. Линия АС характеризует охлаждение раствора до температуры T2 и пересекает кривую растворимости в точке В.
Если кристаллизация начинается только при температуре T2 и при этой температуре заканчивается, то процесс кристаллизации изобразится линией СD. Точка D на кривой растворимости, соответствующая равновесной концентрации С2, соответствует конечному состоянию раствора. Если раствор не может быть пересыщенным, т.е. процесс кристаллизации начинается при равновесной концентрации, то процесс охлаждения и кристаллизации изобразится линией АВD. В реальности процесс охлаждения и кристаллизации может протекать в соответствии с линиями АВ'D'D или АВ"D.
Метод, при котором раствор переводят в пересыщенное состояние за счет удаления растворителя, называется изотермической кристаллизацией. На диаграмме растворимости (рис..5) изменение концентрации раствора от начала процесса (точка А) изобразится линией AEG. Линия АЕ, характеризующая процесс выпаривания до концентрации насыщения, показывает, что с повышением концентрации повышается температура кипения раствора. В большинстве случаев кристаллизация при выпаривании протекает при постоянной концентрации раствора, близкой к состоянию насыщения для данной температуры  .
.
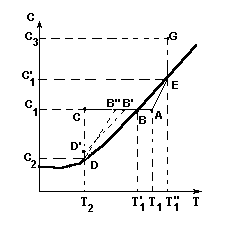
Рис. 5. Изображение процесса кристаллизации на диаграмме растворимости
Существуют и другие методы кристаллизации: высаливанием, вымораживанием, в результате химической реакции. При высаливании к раствору добавляют вещество, понижающее растворимость выделяемой соли. При вымораживании охлаждают раствор до температуры образования кристаллов растворителя (льда). Достичь пересыщения возможно и в результате химических реакций, проходящих в растворе.
Выбор того или иного метода кристаллизации зависит от свойств растворителя и выделяемого вещества. Для веществ, растворимость которых резко уменьшается. с понижением температуры (КNO3, K2Cr2O3, NH4CL и др), кристаллизацию целесообразно проводить изогидрическим методом. В противном случае (NaCL) применяется изотермическая кристаллизация.
Из сказанного выше следует, что процесс кристаллизации происходит только тогда, когда исходная фаза находится в состоянии пересыщения. Поскольку пересыщенные растворы неустойчивы, то из них выделяется избыточное количество растворенного вещества, т.е. происходит процесс кристаллизации. После прекращения выделения кристаллов раствор становится насыщенным. Такой раствор называется маточным, его отделяют от кристаллов путем отстаивания, фильтрования, центрифугирования и др.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 788; Нарушение авторских прав?; Мы поможем в написании вашей работы!