
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Галогены
|
|
|
|
Круговороты биогенных микроэлементов
Круговорот калия
Геохимический цикл этого биофильного элемента протекает преимущественно в земной коре. Он включает разнообразные процессы выветривания горных пород и кристаллохимические превращения силикатных пород, в результате которых катионы калия К+ высвобождаются и затем поглощаются корневой системой растений. В биологическом звене своего круговорота калий участвует в процессах фотосинтеза, существенно влияет на обмен углеводов, азотсодержащих и фосфорных соединений. Он концентрируется преимущественно в семенах, плодах, органах и тканях растений. Поскольку во всех живых организмах калий содержится в ионной форме, практически не образуя при этом соединений с органическими веществами, при отмирании организмов он быстро переходит в окружающую среду (почвы и грунты) и вовлекается в круговорот живым веществом суши.
Круговорот калия в гидросфере практически не изучен. Ежегодно до 90 млн т его поступает с водным стоком в Мировой океан и лишь некоторая часть этой массы поглощается гидробионтами, а остальная не фиксируется и дальнейшие пути ее неизвестны.
Микроэлементы, как и макроэлементы, мигрируют между организмами и средой. Многие из них концентрируются в тканях благодаря химическому сходству с какими-либо важными биогенными элементами, что может оказаться опасным для организма. Некоторые второстепенные элементы попадают в круговорот в результате деятельности человека. Угрозу представляют токсичные отходы, все в больших объемах сбрасываемые в окружающую среду и примешивающиеся к основным круговоротам жизненно важных элементов. Большинство второстепенных элементов в концентрациях и формах, обычных для природных систем, не оказывают отрицательного влияния на организмы, так как последние к ним адаптированы. Но и очень редкий элемент, если он вносится в среду в форме высокотоксичного соединения металла или искусственного радиоактивного изотопа, может приобрести важное значение, так как даже небольшие количества такого вещества способно оказывать значительный биологический эффект.
Самым распространенным из галогенов является хлор, который содержится в биосфере в макроколичествах, тогда как фтор, бром, йод являются микроэлементами. Все галогены имеют сходное строение внешнего электронного слоя.
Галогены в природных условиях играют важную роль в биохимических процессах. Их анионы подвижны в земной коре, хотя могут проявлять литофильные свойства.
Соединения хлора. Химия соединений хлора в биосфере сравнительно проста. Практически все встречающиеся в почвах хлориды легко растворимы: NaCl, KC1, СаС12, MgCl2. Растворимы также хлориды большинства микроэлементов, за исключением хлоридов серебра и ртути. Хлорид-ион может удерживаться в почве в виде обменного аниона, что характерно для органогенных почв с повышенной плотностью положительных зарядов. Уровни содержания хлоридов колеблются в широких пределах: от 1-10 мг/кг в почвах гумидных областей до нескольких процентов в засоленных почвах,
В природной обстановке хлориды в значительных количествах накапливаются, только в засоленных почвах, преимущественно в регионах с аридным климатом. Однако широкое применение хлорида натрия для очистки автострад от снега и льда и в других технических целях привело к тому, что даже в условиях влажного климата хлорид-ион стал входить в число наиболее распространенных загрязняющих веществ.
Соединения йода. Содержание йода в земной коре колеблется от 0,01 до 6 мг/ кг, достигая максимума в обогащенных органическим веществом сланцах. Минеральные соединения йода легкорастворимы, поэтому йод энергично выносится в гидросферу при выветривании горных пород. Химия йода как биофильного элемента во многом обусловлена его участием в биологических процессах. Йод входит в состав тироксина - гормона щитовидной железы, и недостаток йода ослабляет ее деятельность, привода к заболеваниям человека (зоб) и животных.
В почвах содержится от 0 1 до 40 мг/кг йода при среднем содержании порядка 3 мг/кг. В почвах ряда островов (Ирландии, Японии, Новой Зеландии) содержание йода может достигать 80 мг/кг, что обусловлено высоким содержанием йода в морской воде. Почвы прибрежной зоны также обогащены йодом, тогда как почвы, сформированные на современных ледниковых отложениях, обычно им обеднены. Легкие почвы гумидных районов также относительно обеднены йодом, а высокогумусные и оглеенные почвы - обогащены. При обычных условиях йод существует в виде иодидов, иодатов, йодорганических соединений. Накоплению йода в почвах способствует обогащение их коллоидными частицами и органическим веществом. В кислых почвах подвижность йода возрастает, что способствует его потерям, особенно при легком механическом составе.
Загрязнения окружающей среды йодом и его соединениями возможно при сжигании углей (вблизи ТЭЦ) или бурых водорослей, из которых добывают йод, а также в районах автомагистралей. Некоторые осадки сточных вод могут служить источником загрязнения поверхностных горизонтов йодом. В связи с развитием ядерной энергетики особую актуальность приобретает проблема выбросов и обнаружения в биосфере долгоживущих радионуклидов  ,
, 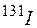 .
.
Соединения брома. Содержание брома в земной коре колеблется от 0,2 до 10 мг/кг, причем максимальные концентрации характерны для глинистых отложений. Бром - сильнолетучий элемент, его соли легкорастворимые. К числу природных минералов брома относятся AgBr, Ag (Br, Сl, I).
Основными антропогенными источниками брома могут быть фумиганты (метилбромид) или пестициды, используемые в газообразном состоянии, калийные удобрения, а также автомобильные выхлопы.
Содержание брома в почвах колеблется от 5 до 40 мг/кг. В торфах и почвах, обогащенных органическим веществом, содержание брома может достигать 120 - 170 мг/кг.
Избыток брома токсичен для растений.
Соединения фтора. Свойства соединений фтора значительно отличаются от свойств других галогенопроизводных.
Фториды щелочных металлов растворимы в воде и их растворимость уменьшается в ряду KF > NaF > LiF. Фтор образует 92 минерала, в том числе фторапатит Са10(РО4)6F2, флюорит CaF2 (48,7% F), криолит 3NaF∙A1F3 (54,3% F), биотит, мусковит (3-4% F), фосфориты (апатиты, химически связанные в разной пропорции с фосфатами кальция) - 0,1-6% F.
Фторсодержащие минералы обычно находятся в горных породах и почвах в рассеянном состоянии, но встречаются и в виде месторождений.
Главными источниками фтора в окружающей среде, в том числе в почве, являются:
1) разрушающиеся горные породы, содержащие в среднем 0,03% F и их минералы (апатит, турмалин, биотит, мусковит, другие слюды);
2) вулканические газы;
3) газопылевые выбросы алюминиевых, сталелитейных, стекольных и фарфоровых заводов, в состав которых входят NaF, KF, NaAlF4, A1F3, CaF2, HF, SiF4;
4) фосфорные удобрения, содержащие от 1 до 4% фтора, фосфогипс (0,3-0,8% F), другие химические мелиоранты.
Фтор накапливается преимущественно в илистой фракции почв (до 70%), тогда как в песчаной фракции его содержание не превышает 0,2-4% от общего количества, поэтому глинистые почвы всегда содержат больше фтора, чем песчаные.
Природный фтор малодоступен растениям. Напротив, поступающие в почву при техногенном загрязнении соединения фтора легкорастворимы и доступны для растений. Значительная часть поступившего фтора либо фиксируется почвенными компонентами (глинистыми минералами, карбонатами кальция, соединениями фосфора), либо выщелачивается из почв легкого механического состава в нижележащие горизонты. Способность почв удерживать фтор обусловливается значениями рН почвенного раствора. Наиболее высокой поглотительной способностью по отношению к фтору характеризуются кислые почвы. По мере возрастания рН способность почв связывать фторид-ион быстро падает.
На территориях, прилегающих к алюминиевым, суперфосфатным, металлургическим заводам, значительно повышается содержание фтора в почвах и растениях. Наибольшие концентрации в почвах аридных регионов бывают приурочены к летнему периоду, в периоды дождей содержание подвижного фтора несколько снижается благодаря его связыванию твердыми фазами и частичному выщелачиванию.
Почвы на известняках сорбируют примерно в 2 раза больше фтора, чем почвы на базальтах, и в 3-4 раза больше, чем песчаные почвы. Интенсивная сорбция фтора имеет важное экологическое значение; это, в частности, снижает поступление фтора в почвенно-грунтовые воды при химическом загрязнении. Преимущественные механизмы связывания — взаимодействие фторид-иона с оксидами и гидроксидами А1 и Fe. При хемосорбции фторида на гидроксидах, вероятно, обменно выделяется в раствор ОН- и рН равновесного раствора повышается. Связывание фторид-иона гидроксидами железа зависит от концентрации F-, рН и строения минеральной фазы. Минимальное связывание наблюдается при рН более 7. В кислой среде связывание фторид-иона увеличивается в ряду гематит<лимонит < гидроксид железа.
При взаимодействии фторидов с А1(ОН)3 значительная часть гидроксида алюминия растворяется вследствие образования комплекса A1FX, если, конечно, в реагирующей системе было высокое отношение (F-):(A1). При низких соотношениях фторид-иона и алюминия твердые фазы устойчивы в диапазоне рН 4-7 и интенсивно фиксируют фторид-ион. Таким образом, избыток F- может переводить в раствор почвенный А1, но в диапазоне рН 4-7 твёрдый А1(ОН)3 может удалять F- из водной фазы, очищая почвенный раствор и предупреждая загрязнение фтором природных вод и растений.
Фтор вызывает сильные изменения природных почв. Добавление к почве NaF практически всегда вызывает увеличение рН, повышает растворимость органического вещества. В кислых почвах эта закономерность более выражена, чем в щелочных. Значительно увеличивается подвижность Al, Fe, Ca, умеренное увеличение характерно для Mg, К, Мn, Р. Небольшое увеличение растворимости (подвижности) выявлено для Cd, Cr, Ni, Cu, Zn, В, Мо, Ва.
Фреоны. Группа фтор- и фторхлоруглеводородов жирного ряда, главным образом метана, которые, благодаря своим термодинамическим свойствам, нашли широкое применение в практике как хладоносители в холодильных машинах, называется фреонами (слово фреон происходит от лат. frigor - холод). Фреоны представляют собой газообразные или жидкие вещества, как правило, хорошо растворимые в органических растворителях, а также во многих смазочных маслах и практически нерастворимые в воде. Фреоны негорючи, не образуют взрывоопасных смесей с воздухом и относительно инертны. Они не действуют на большинство металлов (до 200°С), стойки к окислителям, кислотам. При контакте с открытым пламенем фреоны разлагаются с образованием токсичных дифтор- и фторхлор-фосгенов. Известны следующие фреоны: CF4 - фреон-14; ССlF3 - фреон-13; CC12F2 - фреон-12; CHC1F2 - фреон-22; CC13F - фреон-11; CBrF3 -фреон-13. Наибольшее значение имеет фреон-12 (Ф-12), получаемый при действии фторида сурьмы (III) на тетрахлорид углерода:
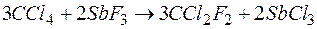
Производство Ф-12 достигает 85% всей мировой продукции фторогранических соединений. Фреоны устойчивы к действию серной кислоты и концентрированных щелочей, не взаимодействуют с большинством металлов. Фреоны нетоксичны для организма, однако их воздействие на окружающую среду может иметь и негативные последствия - образование «озоновой дыры».
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2324; Нарушение авторских прав?; Мы поможем в написании вашей работы!