
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ядерная физика. Строение атомного ядра
|
|
|
|
Э. Резерфорд, проделав эксперимент по изучению рассеяния a-частиц при прохождении через тонкие пленки золота, пришел к выводу о том, что атом состоит из положительно заряженного ядра и окружающих его электронов. Резерфорд показал, что атомные ядра имеют размеры примерно 10-14–10-15 м, в то время как линейные размеры атома примерно 10-10 м. Открытие атомных ядер привело к возникновению новой проблемы в экспериментальной и теоретической физике – проблемы строения и свойств атомного ядра.
Физики-экспериментаторы, инженеры разработали совершенную экспериментальную технику, методы исследования объектов микромира, с помощью которых смогли получить, проанализировать и обобщить огромный объем информации об атомных ядрах различных атомов.
Электрический заряд ядра. Точные измерения электрического заряда Q атомных ядер были выполнены в 1913 году Г.Мозли. Оказалось, что электрический заряд ядра атома
Q = Ze (19.1)
где e – элементарный электрический заряд, Z – порядковый номер химического элемента в таблице Менделеева или зарядовое число ядра. Атомы, ядра которых обладают одинаковыми зарядами, имеют одинаковое строение электронных оболочек и поэтому химически идентичны.
Масса атомного ядра. Другой важной характеристикой атомного ядра является его масса m я. В ядерной физике и физике элементарных частиц в качестве единицы массы используется атомная единица массы (а.е.м.), равная 1/12 массы атома углерода  :
:
1 а.е.м. =1,66 . 10-27 кг.
Энергетический эквивалент атомной единицы массы, т.е. энергия покоя частицы массой 1 а.е.м.:
Е 0 = m 0 c 2 = 1,66 . 10-27. (3 . 108 )2 Дж = 931,5Мэв.
Изотопы. Развитие техники масс-спектрометрии позволило установить, что большинство химических элементов представляют собой смесь атомов с одинаковым зарядовым числом Z, но с различными массами М. Такие атомы назвали изотопами элемента. Например, в природе есть три вида атомов водорода. Масса ядра самого легкого изотопа водорода – протия – равна примерно 1а.е.м.; масса ядра атома второго изотопа водорода – дейтерия – равна примерно 2 а.е.м.; масса ядра атома третьего изотопа водорода – трития – равна примерно 3 а.е.м.
Ядро обозначается тем же символом, что и нейтральный атом: 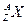 , где X – символ химического элемента, Z – атомный номер элемента (заряд ядра в единицах элементарного заряда), А – массовое число.
, где X – символ химического элемента, Z – атомный номер элемента (заряд ядра в единицах элементарного заряда), А – массовое число.
Состав атомного ядра. Первая частица, входящая в состав атомных ядер, была открыта Э.Резерфордом в 1919 г. Он исследовал взаимодействие a-частиц с ядрами атомов азота и установил, что a-частицы выбивают из ядра положительно заряженные частицы, масса которых равна массе ядра атома водорода 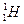 :
:
 . (19.2)
. (19.2)
Эти частицы назвали протонами. Выполнив опыты с атомами других веществ, Резерфорд получил такой же результат: a-частицы выбивают из ядер протоны. Было сделано предположение, что ядра атомов всех элементов содержат протоны. Заряд протона положительный и равен элементарному заряду е. Масса протона m p = 1,6726×10-27 кг = 1,00728 а.е.м.» 1836 m е, где m е – масса электрона. Обозначение протона -  .
.
В 1932 г. Дж. Чедвик выполнил опыты по изучению свойств излучения, возникающего при облучении бериллия a-частицами в следующей реакции:
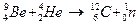 . (19.3)
. (19.3)
Он установил, что излучение является потоком нейтральных частиц с массой, примерно равной массе протона. Опыты Чедвика явились экспериментальным доказательством существования нейтронов. Заряд нейтрона равен нулю, масса нейтрона mn = 1,6749×10-27 кг = 1,00866 а.е.м.» 1839 m е, обозначение нейтрона – 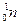 . Важно отметить, что масса нейтрона немного больше массы протона. Это объясняет отсутствие нейтронов в природе в свободном состоянии. Покидая ядро, нейтрон может распадаться на протон, электрон и электронное нейтрино и делает это в среднем за семнадцать минут.
. Важно отметить, что масса нейтрона немного больше массы протона. Это объясняет отсутствие нейтронов в природе в свободном состоянии. Покидая ядро, нейтрон может распадаться на протон, электрон и электронное нейтрино и делает это в среднем за семнадцать минут.
После открытия нейтрона Д. Иваненко и В. Гейзенбергом в 1932 г. была предложена протонно-нейтронная модель ядра. Согласно этой модели атомное ядро состоит из протонов и нейтронов. Число протонов в ядре равно зарядовому числу Z, число нейтронов обозначается буквой N, общее число протонов и нейтронов в ядре равно массовому числу А:
А = Z + N. (19.4)
Протоны и нейтроны называются нуклонами (от лат. nucleus – ядро).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 421; Нарушение авторских прав?; Мы поможем в написании вашей работы!