
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Капиллярные явления
|
|
|
|
Характерным свойством равновесного состояния химически реагирующей системы является то, что неизменность концентраций всех реагирующих частиц во времени есть следствие непрерывно идущих химических процессов. Химическое равновесие - это динамическое равновесие.
Реакции, которые при одной и той же температуре в зависимости от соотношения реагентов могут протекать как в прямом, так и в обратном направлении, называются обратимыми. Общий предел прямой и обратимой реакции называется состоянием равновесия.
Лекция 18. Химическое равновесие.
18.1. Обратимые и необратимые химические реакции.
18.2. Химическое равновесие. Кинетический подход.
18.3. Константы Кp и Кс, связь между ними.
18.1. Даже в тех случаях, когда термодинамика разрешает, а кинетика позволяет самопроизвольно протекать химической реакции, последняя далеко не всегда доходит до конца, т.е. до полного исчезновения исходных веществ. Например, при синтезе аммиака невозможно заставить полностью вступить в реакцию относительно дорогой водород, часть его всегда, при любых условиях, остается не прореагировавшей.
Химики уже давно обратили внимание на то, что некоторые реакции не идут до конца и могут самопроизвольно проходить как в прямом, так и в обратном направлении. Эти наблюдения способствовали развитию во второй половине XIX в. химической термодинамики, стимулируя введение в круг ее проблем понятия энтропии и формируя представления о равновесном состоянии химически реагирующих систем.
.Если через трубку, заполненную оксидом железа, пропускать водород, то в результате реакции
FезO4(ТВ) + 4Н2 (r) = 3Fe(TB) + 4Н20(r)
получаются железо и пары воды. Реакция легко и быстро идет при температуре 500-600 0 С, но часть водорода, разная при разных температурах, остается не -прореагировавшей. Причем при заданной температуре отношение РН2O / РН2 после достижения определенного значения перестает зависеть от времени контакта газовой смеси с оксидом. Ни уменьшение скорости газового потока, ни увеличение слоя оксида не сказываются на отношении РН2O / РН2. Более того, если трубку заполнить металлическим железом и при той же температуре пропускать над ним водяной пар, то часть воды остается не прореагировавшей, причем отношение
РН2O / РН2 в парогазовой смеси, прошедшей через слой железа, оказывается таким же, как и при пропускании водорода над оксидом.
Таким образом, реакция восстановления оксида железа водородом при одних и тех же условиях (Т и Р) может быть проведена как в прямом, так и в обратном направлении.
Следует подчеркнуть, что если в закрытой системе обратимая реакция доходит только до состояния равновесия, то в условиях открытой системы во многих случаях она может быть доведена до конца.
Например, пропуская водород через трубку с оксидом железа достаточно долго и, самое главное, удаляя при этом воду из зоны реакции, можно полностью, практически до конца, восстановить оксид или, напротив, полностью окислить железо, пропуская водяной пар и удаляя образующийся водород.
Состояние равновесия существенно зависит от температуры и во многих случаях так сильно сдвинуто в сторону продуктов реакции, что практически реакция идет до конца. Например, даже при 1000 0 С парциальные давления водорода и кислорода, находящихся в равновесии с водяным паром, столь малы, что могут быть определены только с помощью специальных методов. В этих условиях реакция 2Н2 + О2 = 2Н2O идет до конца. Однако уже при 2000 °С парциальные давления водорода и кислорода составляют около 1 % от общего давления, а при 5000 0 С вода практически нацело разлагается на водород и кислород.
Отметим, что обе реакции - и прямая, и обратная - к состоянию равновесия идут самопроизвольно. Например, при 300 0 С равновесное состояние, достигаемое в результате реакции
NO (r) + 1 /2 O2 (г) = N02 (г),
таково, что парциальные давления всех трех веществ примерно одинаковы. Если приготовить при этой температуре смесь NO + 1/2 02, то в ней самопроизвольно пойдет реакция образования N02, но прореагирует только половина исходных веществ, Если же в эти условия поместить чистый N02, то он будет самопроизвольно разлагаться, но разложится лишь наполовину. Для того, чтобы подчеркнуть обратимость реакции, вместо знака равно (=) используют знак ↔.
Реакции взаимодействия кислорода с водородом, углеродом, серой, вообще говоря, обратимы, но мы проводим их в таких условиях, в которых они идут практически до конца.
Однако существуют и необратимые реакции, которые при любых мыслимых условиях самопроизвольно могут идти в одном направлении. Например, ни при каких условиях продукты взрыва пороха, т.е. реакции
2 KNO3 + 3С + S = K2S + 3С02 + N2,
не прореагируют самопроизвольно обратно.
Именно самопроизвольно. Для превращения продуктов реакции обратно в исходные вещества надо произвести работу. Даже если взрыв произошел в замкнутом объеме, надо затратить работу на отделение газа от твердого K2S, на разделение СО2 и N2. Надо затратить энергию, чтобы разложить K2S и СО2 на простые вещества, надо окислить азот и вновь получить KNO3, а потом еще затратить работу на приготовление исходной смеси. Следовательно, получить исходные вещества из продуктов необратимой реакции безусловно можно, но отнюдь не в результате самопроизвольного процесса.
Вернемся к обратимым реакциям. Чем обусловлено существование предела протекания реакции? В каких случаях возможно самопроизвольное протекание прямой и обратной реакций? Существует два подхода, позволяющих получить ответы на эти вопросы: кинетический и термодинамический.
18.2. Обратимся к уже упоминавшейся реакции взаимодействия водорода с газообразным иодом. В данном случае порядок реакции по каждому веществу совпадает со стехиометрическим коэффициентом:
Н2(г) + I2(г) = 2HI(г) v = k[H2][I2];
при 700 К константа скорости k = 0,1 л/ (моль۰с). Допустим, в некоторый сосуд при 700 К введены водород и пары йода так, что их концентрации [Н2] = [12] =
= 10 -2 моль/л. Немедленно начинается реакция, скорость которой в первый момент
Vнач = 0,1۰10 -2۰ 10-2 = 10 -5 моль/ (л ۰ с).
По мере того как концентрация иода и водорода уменьшаются, скорость реакции падает, а поскольку уравнение скорости имеет общий второй порядок, падение скорости происходит по параболическому закону (рис. 4.1, кривая 1).
Рис. 4.1 Изменение скорости прямой v (1) и обратной v (2) реакций в процессе установления равновесия Н2 + I2 ↔ 2HI в газовой фазе при 700 К
В конце концов Vn p. должна была бы уменьшиться до нуля, но по мере накопления HI становится возможной обратная реакция, скорость которой определяется уравнением
Vсбр = kобр [HI] 2;
при 700 К kобр = 0,0018 л/ (моль ۰ с) Допустим, что введенные в сосуд водород и йод полностью прореагировали с образованием HI. Тогда его максимальная концентрация будет равна
[HI] = 2 [Н2] = 2 [I2 ]=2 ۰ 10-2 моль/л,
а максимально возможная скорость разложения
V макс =1,8۰ 10-3 (2*10-2)2 = 7 ۰ 10-7 моль/(л۰с).
К этой величине, как к пределу, стремится скорость обратной реакции, возрастающая по параболическому закону по мере накопления в системе HI (рис. 4.1.,кривая 2)
Поскольку с течением времени скорость прямой реакции падает, а скорость обратной растет, то через некоторое время скорости обеих реакций окажутся равными. Начиная с этого момента (равн.), обе скорости перестают меняться и наступает состояние равновесия: сколько HI образуется по прямой реакции, столько же распадается по обратной. В состоянии равновесия концентрации всех участников перестают меняться.
Рассмотрим более подробно ситуацию, возникающую при равенстве скоростей прямой и обратной реакций. В этих условиях справедливо равенство
K пр =[Н2][12]=k обр[HI]2,
а так как константы скоростей не зависят от концентрации, его удобно записать иначе:
kпр /kобр = [HI]2 / [Н2][12] = K
Отношение констант скоростей прямой и обратной реакций, как и сами константы, зависит от природы реагирующих веществ и температуры. Это отношение называется константой равновесия и обозначается К. Правая часть равенства представляет собой отношение концентраций участников равновесия, которое мы будем называть выражением константы равновесия. Очевидно, что для данного равновесия при определенной температуре это отношение постоянно и равно К. Таким образом, значение константы определяет, каким должно быть соотношение концентраций всех реагирующих веществ при равновесии.
Сколь бы сложны ни были механизмы прямой и обратной реакций, но в состоянии равновесия они должны обеспечить стехиометрический переход исходных веществ в продукты реакции и обратно. Это означает, что после исключения всех промежуточных веществ в выражение константы равновесия концентрации исходных веществ и продуктов реакции входят в показателях степени, равных стехиометрическим коэффициентам суммарной реакции. Наконец, так как выражение константы не зависит от механизма реакции, то смена механизма, например при введении катализатора, не влияет на величину константы равновесия, но, конечно, меняет скорость достижения равновесного состояния.
Константа равновесия - важнейшая характеристика химического взаимодействия. Ее величина позволяет судить о полноте протекания реакции. Для необратимых реакций (протекающих до конца) К → ∞, поскольку равновесная концентрация продуктов реакции намного превышает концентрацию исходных веществ. Если К → 0, то это свидетельствует о практически полном отсутствии взаимодействия в прямом направлении.
Достижению химического равновесия часто препятствуют факторы, связанные с особенностями кинетики процессов, т.е. преодолением активационных барьеров. Значительная величина энергетического барьера может практически полностью воспрепятствовать достижению химического равновесия, в результате чего можно прийти к неправильному выводу о том, что система уже находится в состоянии химического равновесия. Так, смесь Н2 + О2 при комнатной температуре может неограниченно долго находиться в неизменном состоянии. Однако это состояние не является равновесным, поскольку внешнее воздействие (например, нагревание) приводит к мгновенному взаимодействию с образованием воды. Если эту систему затем охладить до прежней температуры, то она не вернется в исходное состояние, так как новое состояние является термодинамически более устойчивым.
Если состояние системы неизменно во времени, но при изменении внешних условий в системе происходит необратимый процесс, то такое состояние называется ложным (заторможенным) равновесием. Особенно характерны ложные равновесия для твердых систем, в которых осуществление химических процессов сильно затруднено за счет малой подвижности частиц и высоких энергетических барьеров.
В отличие от ложного истинное химическое равновесие не только неизменно во времени в отсутствие внешних воздействий, но и после воздействия система может вернуться в прежнее состояние. Классическим примером истинного равновесия является равновесие в системе N2O4 = 2N02. При нагревании в замкнутом объеме димер N2O4 дисcоциирует на две молекулы NO2. При охлаждении же система возвращается в исходное состояние: из двух молекул N02 вновь образуется N2O4. Истинное химическое равновесие характеризуется минимальным значением свободной энергии (ΔG = 0). При ложном равновесии ΔG < 0, т.е. не исключена возможность протекания химического процесса.
В выражение для константы равновесия не входят вещества, концентрации которых меняются мало или вообще не меняются в результате реакции. Одно из таких веществ - растворитель (в выражении констант диссоциации кислот - это вода). Другим таким веществом может быть вещество, находящееся в индивидуальном состоянии (а не в растворе), так что оно в процессе реакции не изменяется, а только расходуется. Поэтому для реакции С + С02 ↔ 2СО
К =[СО]2/[С02] и отсутствует выражение [С]
Термодинамический подход к химическому равновесию будет рассмотрен в лекции 20.
18.3. Для реакций в растворах концентрацию обычно выражают в моль/л, т.е. указывают молярную концентрацию или молярность. Для реакций в газовой фазе в качестве единиц измерения концентрации можно также пользоваться молярностью, но можно наряду с этим измерять концентрации парциальными давлениями соответствующих газов. При использовании молярных концентраций константу равновесия обозначают символом Кс, а при измерении концентраций газообразных веществ в единицах давления константу равновесия обозначают символом Kp. Поскольку численные значения констант Кс и Кр должны быть разными, следует всегда указывать с помощью нижних индексов, какой константой мы пользуемся.
Уравнение состояния идеального газа позволяет найти связь между парциальными давлениями и молярными концентрациями и, следовательно, дает возможность переходить от Кс к Кр, и наоборот.
PV = n RT, откуда P = n/v RT = CRT, где n/v - молярная концентрация С газа (число его молей в литре). Найденное соотношение между давлением и молярной концентрацией газа позволяет установить общее выражение, связывающее между собой Кр и Кс.
Кр = Кс (RT) Δn
Величина Δ n означает изменение числа молей газа при переходе от реагентов к продуктам, т.е. разность между числом молей газообразных продуктов и числом молей газообразных реагентов. Например в реакции:
Н2(r) + I 2(r) ↔ 2 HI(r)
2 моля HJ образуется из двух молей газообразных реагентов (1моль Н2 + 1моль I2). Следовательно Δn = 2 - 2 = 0 и поэтому для данной реакции Кс = Кр.
Пусть жидкость находится в каком-либо сосуде. Если расстояния между поверхностями, ограничивающими жидкость сравнимы с радиусом кривизны поверхности жидкости, то такие сосуды называются капиллярами. Явления, происходящие в капиллярах, называются капиллярными явлениями. К капиллярным явлениям относят капиллярный подъём жидкости и капиллярное сцепление между смачиваемыми поверхностями.
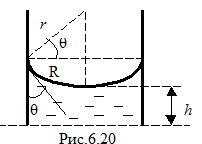 Наиболее простыми и часто используемыми капиллярами являются цилиндрические капилляры (рис.6.20). Поверхность жидкости в таких капиллярах является сферической. Пусть r - радиус кривизны поверхности жидкости, R – радиус капилляра, θ – краевой угол. В случае частичного смачивания жидкость будет подниматься по капилляру под действием давления Лапласа, до тех пор, пока его не скомпенсирует гидравлическое давление жидкости:
Наиболее простыми и часто используемыми капиллярами являются цилиндрические капилляры (рис.6.20). Поверхность жидкости в таких капиллярах является сферической. Пусть r - радиус кривизны поверхности жидкости, R – радиус капилляра, θ – краевой угол. В случае частичного смачивания жидкость будет подниматься по капилляру под действием давления Лапласа, до тех пор, пока его не скомпенсирует гидравлическое давление жидкости:
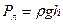 , (6.46)
, (6.46)
 где ρ – плотность жидкости, g – ускорение силы тяжести, h – высота капиллярного подъёма. Радиус кривизны поверхности жидкости удобно выразить через радиус капилляра, который можно легко измерить:
где ρ – плотность жидкости, g – ускорение силы тяжести, h – высота капиллярного подъёма. Радиус кривизны поверхности жидкости удобно выразить через радиус капилляра, который можно легко измерить: 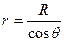 . Давление Лапласа для сферической поверхности определяют по формуле (6.42). Подставляя его выражение в формулу (6.46), получим:
. Давление Лапласа для сферической поверхности определяют по формуле (6.42). Подставляя его выражение в формулу (6.46), получим:
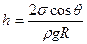 (6.47)
(6.47)
В случае полного смачивания θ =0о, cos θ =1, r = R и формула высоты капиллярного подъёма имеет вид:

 (6.48)
(6.48)
При полном несмачивании θ=180о, cos θ = - 1, и высота капиллярного подъёма будет отрицательной, то есть поверхность жидкости опустится на величину h (рис. 6.21).
Интересно отметить, что в сообщающихся капиллярах высота уровня жидкости не одинакова. Наибольший капиллярный подъём наблюдается в самом узком капилляре, а наименьший – в самом широком капилляре (рис.6.22).
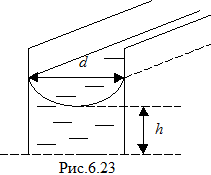 В случае капиллярного подъёма между двумя плоскопараллельными поверхностями, находящимися на расстоянии d (рис.6.23), поверхность жидкости будет иметь цилиндрическую форму. Радиус кривизны поверхности выразим через расстояние между поверхностями:
В случае капиллярного подъёма между двумя плоскопараллельными поверхностями, находящимися на расстоянии d (рис.6.23), поверхность жидкости будет иметь цилиндрическую форму. Радиус кривизны поверхности выразим через расстояние между поверхностями: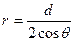 . Высота подъёма жидкости по-прежнему будет определена условием (6.46). Высота капиллярного подъёма в этом случае равна:
. Высота подъёма жидкости по-прежнему будет определена условием (6.46). Высота капиллярного подъёма в этом случае равна:
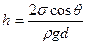 (6.49)
(6.49)
Для полного смачивания 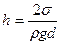 . Капиллярные явления наблюдаются при подъёме воды к поверхности почвы, при использовании промокательной бумаги, тряпки, при подъёме керосина в фитилях и т.п.
. Капиллярные явления наблюдаются при подъёме воды к поверхности почвы, при использовании промокательной бумаги, тряпки, при подъёме керосина в фитилях и т.п.
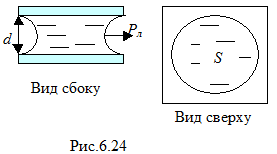 Капиллярное сцепление. Известно, что две пластины, смоченные жидкостью, очень трудно разъединить, прикладывая силу в направлении, перпендикулярном пластинам. Причина такого сильного взаимодействия пластин – наличие отрицательного давления Лапласа. Любой элемент свободной поверхности жидкости представляет собой вогнутый цилиндр (рис.6.24). Давление, возникающее из-за кривизны поверхности, будет отрицательным. Следовательно, давление в жидкости будет меньше нормального на величину давления Лапласа, которое для цилиндрической поверхности в случае полного смачивания будет равно
Капиллярное сцепление. Известно, что две пластины, смоченные жидкостью, очень трудно разъединить, прикладывая силу в направлении, перпендикулярном пластинам. Причина такого сильного взаимодействия пластин – наличие отрицательного давления Лапласа. Любой элемент свободной поверхности жидкости представляет собой вогнутый цилиндр (рис.6.24). Давление, возникающее из-за кривизны поверхности, будет отрицательным. Следовательно, давление в жидкости будет меньше нормального на величину давления Лапласа, которое для цилиндрической поверхности в случае полного смачивания будет равно
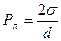 , где d – расстояние между пластинами.
, где d – расстояние между пластинами.
Пластины будут сдавлены давлением Лапласа. Сила сцепления пластин может быть определена по формуле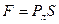 , где S – площадь пластины, смоченной жидкостью (площадь основания вогнутого цилиндра). При малом зазоре d между пластинами, давление Лапласа велико и сила сцепления имеет большое значение. Сила сцепления также возрастает при увеличении площади поверхности пластины, смоченной жидкостью.
, где S – площадь пластины, смоченной жидкостью (площадь основания вогнутого цилиндра). При малом зазоре d между пластинами, давление Лапласа велико и сила сцепления имеет большое значение. Сила сцепления также возрастает при увеличении площади поверхности пластины, смоченной жидкостью.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 669; Нарушение авторских прав?; Мы поможем в написании вашей работы!