
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория мономолекулярной адсорбции
|
|
|
|
(Теория Ленгмюра 1915 год)
Исходные положения:
1) На поверхности адсорбента имеются активные центры, на которых происходит адсорбция, они занимают малую часть поверхности. Активными центрами могут служить различные неоднородности поверхности: выступающие атомы, ребра кристаллов, дефекты кристаллической решетки, микротрещины, атомы примесей и другие.
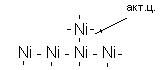
2) Адсорбционные силы имеют природу, близкую к химической, поэтому они способны к насыщению. Следовательно, на одном адсорбционном центре адсорбируется только одна молекула, в итоге на поверхности образуется лишь мономолекулярный слой адсорбтива.
3) Адсорбируемые молекулы через некоторое время десорбируются, на их место адсорбируются новые, устанавливается динамическое равновесие.
4) Взаимодействием между адсорбированными молекулами можно пренебречь.
Исходя из этих положений, выведем уравнение, описывающее изотерму адсорбции.
Обратимый процесс адсорбции можно записать как следующую реакцию.
молекула + свободный активный центр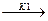 /
/ адсорбционный комплекс
адсорбционный комплекс
(занятый активный центр)
В равновесии υ1 = υ2,введем обозначения:
αmax - общее число активных центров на единице поверхности;
α - число занятых активных центров на единице поверхности (поверхностная концентрация адсорбтива)
(αmax−α) - число свободных активных центров на единице поверхности.
k1∙Р∙ (αmax−α) = k2∙α
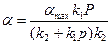 , поделим левую часть на k2,
, поделим левую часть на k2,
обозначим буквой K константу равновесия адсорбционного процесса 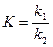 ,
,
тогда 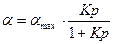 - уравнение Ленгмюра, оно описывает всю изотерму.
- уравнение Ленгмюра, оно описывает всю изотерму.
I участок K·Р << 1; 
III участок K∙Р >>1; 
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!