
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродвижущая сила (ЭДС) гальванического элемента
|
|
|
|
Реакции на электродах
Элемент Даниэля-Якоби
Гальванический элемент
(рис. DSC00804)
Если соединить цинковый и медный электроды проводником, то электроны будут переходить с цинковой пластины, заряженной отрицательно, на медную, заряженную или менее отрицательно, или даже положительно. Появляется электрический ток. При этом равновесие ДЭС нарушается. Новые ионы цинка будут переходить в раствор. На медной пластинке будут разряжаться ионы меди. Пойдет самопроизвольный процесс.
Гальваническим элементом называется устройство, в котором химическая энергия превратится в электрическую.
(А) Zn + Cu2+→ Zn2+ + Cu - окисление
Электрод, на котором происходит окисление, называется анодом, в гальваническом элементе обозначается А(-).
(К) Cu2+ + 2e→ Cu - восстановление
Реакция в гальванических элементах в ионной форме Zn + Cu2+ → Zn2+ + Cu
В молекулярной форме Zn + CuSO4 → Zn SO4 + Cu
Условная запись гальванического элемента (-) Zn׀ Zn2+¦ Cu2+׀ Cu (+)
С ключом (нет диффузионного потенциала на границе двух растворов)
(-) Zn׀ Zn2+ ║ Cu2+׀ Cu (+)
ЭДС источника тока называется величина, численно равная работе сторонних сил по перемещению единичного заряда внутри источника тока с одного полюса на другой.
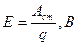
Согласно закону Ома для полной цепи, разность потенциалов на полюсах источника тока меньше, чем ЭДС на величину падения напряжения внутри источника тока.

Если ток в цепи бесконечно мал, то гальванический элемент работает обратимо, электродные потенциалы являются равновесными, падение напряжения внутри источника тока бесконечно мало. ЭДС гальванического элемента равна разности равновесных электродных потенциалов:
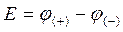
В гальваническом элементе работа сторонних сил – это полезная работа химических реакций (полезная работа равна всей работе за вычетом работы расширения).
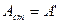
В обратимых условиях работы полезная работа максимально равна убыли энергии Гиббса.

Изменение энергии Гиббса в ходе реакции вычисляется по уравнению изотермы реакции.
Для реакции
ν1А1 + ν2А2 → ν3А3 + ν4А4
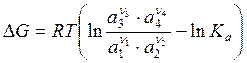 ,
,
здесь ΔG вычислена в расчете на один пробег реакции, то есть на 1 моль того вещества, которое имеет стехиометрический коэффициент, равный 1 или на νi молей вещества с коэффициентом νi. При этом, заряд, проходящий через раствор
 ,
,
где Z - зарядовое число, F – постоянная Фарадея.
ЭДС гальванического элемента
 - уравнение Нернста.
- уравнение Нернста.
Здесь  - стандартная ЭДС.
- стандартная ЭДС.
Пример. Для гальванического элемента Даниэля-Якоби.
Zn + Cu2+↔ Zn2+ + Cu

Определение электродных потенциалов
Электродный потенциал – это разность потенциалов между металлом и раствором. Для его измерения в раствор нужно вводить второй электрод, поэтому измерять приходится разность потенциалов между первым и вторым электродом.
В качестве второго электрода – электрода сравнения принимают нормальный (стандартный) водородный электрод. Его потенциал принимают равным нулю.
(рис. DSC00806, DSC00809)
Достоинства: высокая точность воспроизведения потенциала. Недостаток: чувствительность к условиям работы.
Более удобно использовать в качестве электрода сравнения другой электрод, например, каломельный (хлорсеребряный) электрод. Его потенциал измерен относительно водородного.
(рис. DSC00799)
Достоинства: стабильность работы, т.к. концентрация анионов Сl-, от которой зависит потенциал практически постоянна.
Для того, чтобы определить потенциал исследуемого электрода (например цинкового) надо этот электрод соединить с водородным и измерить ЭДС полученного гальванического элемента. При этом предполагается, что исследуемый электрод имеет положительный потенциал, поэтому он записывается справа.
Pt, H2 | H+ || Zn2+ |І Zn
Предполагаемая реакция Zn2+ + H2 ↔ Zn + 2H+
ЭДС этого элемента 
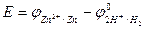

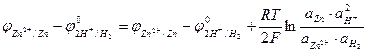


 φZn2+ І Zn = φ0 Zn2+ І Zn +(RT/2F) ln aZn2+
φZn2+ І Zn = φ0 Zn2+ І Zn +(RT/2F) ln aZn2+
Получаем формулу для расчета потенциала металлического электрода 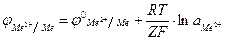
при 250С 

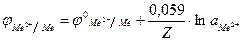 .
.
Измерение ЭДС
ЭДС гальванического элемента равна разности равновесных электродных потенциалов. Электродные потенциалы являются равновесными, если сила тока в них бесконечно мала. Поэтому для измерения ЭДС применяют компенсационный метод.
Метод Поггендорфа.
(рис. DSCOO798)
Метод заключается в том, что ЭДС исследуемого элемента компенсируется напряжением, взятым от батареи, ЭДС которой известна. ЭДС батареи перед измерением проверяется по нормальному элементу, ЭДС которого известна с высокой точностью и сохраняет свое значение очень долго.
Измерение ЭДС заключается в следующем: перемещением рукоятки потенциометра измеряют его сопротивление и, соответственно, напряжение, подаваемое на исследуемый элемент. Добиваются такого положения рукоятки потенциометра, при котором сила тока в цепи, измеряется гальванометром I=0. при этом ЭДС исследуемого элемента
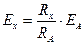 ,
,
где ЕА – ЭДС батареи, RA – полное сопротивление потенциометра, Rx – сопротивление части потенциометра, с которой снимается напряжение, подаваемое на гальванический элемент.
(6) Классификация электродов
1. Электроды первого рода – это электроды, обратимые относительно катиона или аниона.
Пример:
1) Zn2+ І Zn – цинковый электрод.
Zn2+ + 2е ↔ Zn
φ = φ0 + RT / 2F * ln a Zn2+
2) хлорный электрод Сl- І 1/2 Сl2,Pt
1/2 Сl2 + e ↔ Сl-
φ = φ0 + RT / F * ln a Cl-
2. Электроды второго рода – это система в которых металл электрода покрыт малорастворимой солью этого металла и находится в растворе, содержащим хорошо растворимый электролит с теми же анионами.
Примеры: 1) Каломелевый
2) Хлорсеребряный электрод
Сl- І AgCl, Ag
AgCl + e ↔ Ag + Сl-
φ = φ0 - RT / F * ln a Сl –
Потенциал такого электрода имеет стабильное значение, так как раствор содержит большое количество анионов, концентрация которых при работе электрода мало изменяется.
3. Окислительно-восстановительные электроды (редокс-электроды), у них окислительная и восстановительная формы находятся в растворе, а электроны отводятся из раствора с помощью инертного металла (Pt).
Пример:
1) Fe3+, Fe2+ І Pt
Fe3+ + e ↔ Fe2+
2) хингидронный электрод H+ І хг, Pt
хг – это эквимолярная смесь хинона (С6H4O2) и гидрохинона (С6H4(OH)2)
С6H4O2 + 2 H+ + 2e ↔ = С6H4(OH)2
Достоинства этого электрода: простота, зависимость от pH среды. Недостаток: не работает в щелочной среде. Отмечают также газовые электроды, амальгамные электроды (раствор металла в ртути).
Классификация гальванических элементов.
1. Химические гальванические элементы, в них ЭДС возникает вследствие различной химической природы электродов.
Пример: гальванический элемент Даниэля-Якоби
2. Концентрационные, в них ЭДС возникает вследствие различной концентрации (активности) растворов или электродов.
Примеры:
1) Аg І AgNO3 І І AgNO3 І Ag
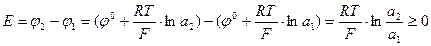 , если а2 >a1
, если а2 >a1
2) Hg, Zn І ZnSO4 І Zn, Hg


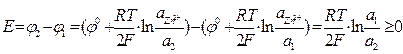 , если а1>a2
, если а1>a2
Положительным будет тот, у которого активность металла в ртути меньше.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 8298; Нарушение авторских прав?; Мы поможем в написании вашей работы!