
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрическое титрование. Потенциометрические определения
|
|
|
|
Потенциометрические определения
Потенциометрические определения – это определения каких-либо свойств, путем измерения ЭДС гальванических элементов. К ним относятся:
1) Определение термодинамических характеристик химических реакций;
2) Определение растворимости малорастворимых соединений;
3) Определение констант гидролиза солей;
4) Определение констант диссоциации кислот и оснований;
5) Определение ионного произведения воды;
6) Определение рН.
Целью потенциометрического титрования является определение общей концентрации кислоты, щелочи или вещества в растворе. Процесс титрования заключается в следующем:
К исследуемому раствору (например, кислоты) по каплям добавляют раствор второго реагента (например, щелочи) с известной концентрацией, когда раствор станет нейтральным можно записать соотношение:

Следовательно, нормальность кислоты: 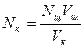 ,
,
где Vк - объем пробы раствора кислоты;
Nк - нормальность кислоты (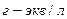 );
);
Vщ – объем щелочи, пошедший на титрование, определенный в точке эквивалентности;
Nщ – нормальность щелочи.
При потенциометрическом титровании, в отличие от обычного титрования, точка эквивалентности определяется не по изменению цвета индикатора, а по скачку ЭДС гальванического элемента. Гальванический элемент состоит из электрода, опущенного в исследуемый раствор, например, хингидронного, и электрода сравнения, например, каломельного или хлорсеребреного.
Электрод, помещаемый в серебреный раствор должен обладать следующим свойством. Его потенциал должен обладать следующим свойством: его потенциал должен зависеть от концентрации определяемого вещества.
Потенциал электрода сравнения должен быть известен.
(рис. DSC00801)
При прибавлении щелочи к раствору кислоты ЭДС гальванического элемента изменяется в точке эквивалентности наблюдается скачек ЭДС. Более точно объем щелочи можно определить по дифференциальной кривой.
Этот метод удобен для прозрачных или окрашенных растворов.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 807; Нарушение авторских прав?; Мы поможем в написании вашей работы!