
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распределение Максвелла
|
|
|
|
Полная энергия системы равна сумме ее потенциальной и кинетической энергий.
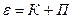
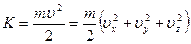

Рассмотрим распределение Больцмана, в котором энергия системы представлена в виде суммы двух слагаемых. По свойству потенциальной функции, выражение можно разложить на произведение двух сомножителей, каждый из которых является функцией определенного вида энергии:

В таком виде выражение называется функцией распределения Максвелла-Больцмана. Сомножитель, зависящий от кинетической энергии, называется функцией Максвелла, а сомножитель, зависящий от потенциальной энергии – функцией Больцмана.
Найдем вероятность того, что молекула имеет скорость в интервале 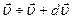 .
.
Плотность вероятности этого – функция распределения Максвелла.
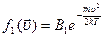

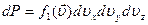
Определим константу 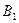 из условия нормировки:
из условия нормировки: 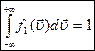
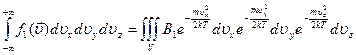 , так как компоненты скорости независимы, то
, так как компоненты скорости независимы, то
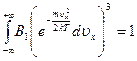 . Обозначим константу
. Обозначим константу 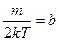 ,
, 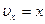 , тогда после замены мы получим табличный интеграл:
, тогда после замены мы получим табличный интеграл:
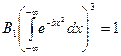 , значение интеграла
, значение интеграла 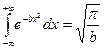 , отсюда получим
, отсюда получим
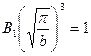 , следовательно:
, следовательно:
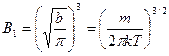 .
.
Таким образом 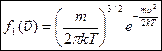 - плотность вероятности молекул иметь скорость в интервале от
- плотность вероятности молекул иметь скорость в интервале от 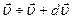 , распределение молекул по проекциям координат.
, распределение молекул по проекциям координат.
Теперь найдем вероятность того, что молекулы имеют скорость в интервале 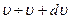 по абсолютному значению (по модулю). Для этого перейдем от распределения проекций скоростей к распределению по модулю скорости. Удобнее переход сделать в системе сферических координат.
по абсолютному значению (по модулю). Для этого перейдем от распределения проекций скоростей к распределению по модулю скорости. Удобнее переход сделать в системе сферических координат.
Оператор Лапласа дает коэффициент перехода от декартовой системы координат к сферической:
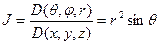 ,
,

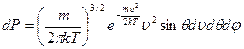
Нас интересуют только абсолютные значения, поэтому:
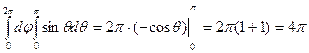 , с учетом вычисленных интегралов:
, с учетом вычисленных интегралов:
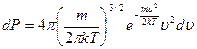 , отсюда плотность вероятности:
, отсюда плотность вероятности:
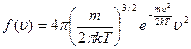
Зная плотность распределения молекул по абсолютному значению скорости, мы можем рассчитать три характеристические скорости движения молекул идеального газа.
Средняя арифметическая скорость:
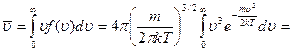 выделим для замены переменной
выделим для замены переменной

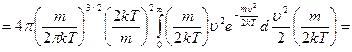 сделаем замену переменной
сделаем замену переменной
и учтем, значение табличного интеграла: 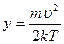 ,
, 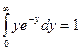 , получим после сокращения констант:
, получим после сокращения констант:
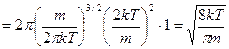 , где
, где  - постоянная Больцмана,
- постоянная Больцмана, 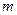 - масса молекулы, преобразуем, умножив числитель и знаменатель дроби на число Авогадро:
- масса молекулы, преобразуем, умножив числитель и знаменатель дроби на число Авогадро:
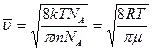 , где
, где 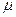 - молярная масса компоненты системы.
- молярная масса компоненты системы.
Результат: 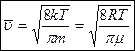 - средняя арифметическая скорость движения молекул идеального газа.
- средняя арифметическая скорость движения молекул идеального газа.
Средняя квадратичная скорость:
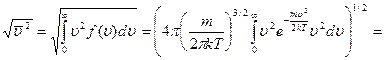 ,
,
сделаем замену переменной:
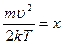 , тогда
, тогда 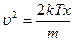 ,
, 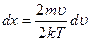 , отсюда
, отсюда 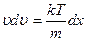 ,
,
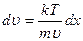 , разделим переменные и найдем связь между
, разделим переменные и найдем связь между 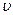 и
и 
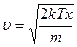 , подставим полученное значение в дифференциал:
, подставим полученное значение в дифференциал:
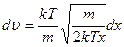 ,
, 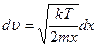 .
.
Подставим все в интеграл:
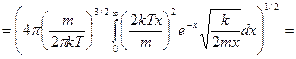 преобразуем,
преобразуем,

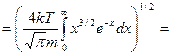 , учтем значение табличного интеграла:
, учтем значение табличного интеграла: 
 , таким образом
, таким образом
 - средняя квадратичная скорость.
- средняя квадратичная скорость.
Наиболее вероятная скорость:
Наиболее вероятная скорость – это скорость, соответствующая максимуму кривой распределения молекул по скоростям, т.е. должно выполнятся условие:
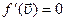

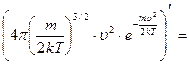 обозначим константу
обозначим константу 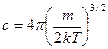 и найдем производную произведения
и найдем производную произведения


так как величина 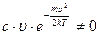 , то должно выполняться условие:
, то должно выполняться условие:
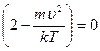 ,
, 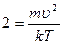 ,
, 
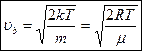 - скорость наиболее вероятная.
- скорость наиболее вероятная.
 При комнатной температуре средняя арифметическая скорость движения молекул:
При комнатной температуре средняя арифметическая скорость движения молекул:
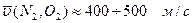 , а характеристические скорости водорода в 4 раза больше.
, а характеристические скорости водорода в 4 раза больше.
Как посчитать число молекул, скорости которых лежат в заданном диапазоне?
Если 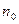 - число молекул в единице объема, то
- число молекул в единице объема, то 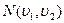 - число молекул, скорости которых распределены в интервале от
- число молекул, скорости которых распределены в интервале от 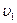 до
до 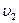 равно:
равно:
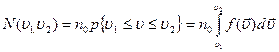 , если учесть что
, если учесть что 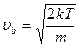 , и введя переменные
, и введя переменные 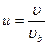 ,
, 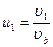 ,
, 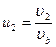 ,
, 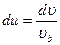 то
то
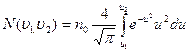 - такой вид более нагляден, для анализа формы кривой распределения Максвелла. В книгах имеются таблицы интеграла:
- такой вид более нагляден, для анализа формы кривой распределения Максвелла. В книгах имеются таблицы интеграла: 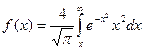 с их помощью упрощаются вычисления величины
с их помощью упрощаются вычисления величины 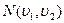 .
.
Из таблиц в частности находим, что:


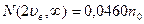
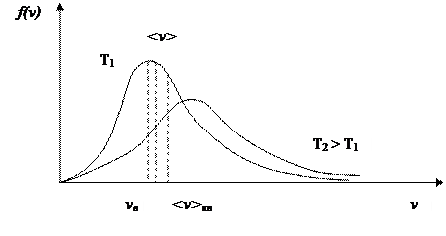
Т.о. большая часть молекул имеет скорости в сравнительно небольшом интервале около наиболее вероятной, а молекул со скоростями вне этого интервала сравнительно мало.
Для экспериментальной проверки было проделано много опытов. Самый известный – опыт Штерна (1920). На оси двух коаксиальных цилиндров ( и
и 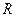 ) расположена платиновая нить, покрытая слоем
) расположена платиновая нить, покрытая слоем 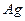 . Нить нагревали током, серебро испарялось, и его атомы хаотично вылетали по всем радиальным направлениям. При этом они имели и различные скорости движения. Воздух внутри цилиндров откачивался, чтобы столкновения молекул серебра с молекулами воздуха не искажали картину. Атомы серебра равномерно покрывали поверхность внешнего цилиндра, что указывало на равновероятность всех направлений их скорости. Затем во внутреннем цилиндре - узкая щель, диафрагмирующая пучок атомов по направлению (скорости любые по величине). Внешний цилиндр приводили во вращение (
. Нить нагревали током, серебро испарялось, и его атомы хаотично вылетали по всем радиальным направлениям. При этом они имели и различные скорости движения. Воздух внутри цилиндров откачивался, чтобы столкновения молекул серебра с молекулами воздуха не искажали картину. Атомы серебра равномерно покрывали поверхность внешнего цилиндра, что указывало на равновероятность всех направлений их скорости. Затем во внутреннем цилиндре - узкая щель, диафрагмирующая пучок атомов по направлению (скорости любые по величине). Внешний цилиндр приводили во вращение (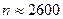 ) об/мин.
) об/мин.
В зависимости от скорости атомы попадают на разные участки поверхности вращающегося цилиндра, согласно формуле на участок АВ:
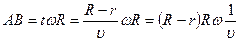 Þ
Þ 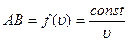 .
.
Чем больше атомов осаждается на стенке, тем толще пленка. Измеряя толщину пленки, можем определить число атомов, обладающих скоростью, лежащей в некотором диапазоне, т.е. построить диаграмму, которая при сглаживании схожа с кривой распределения Максвелла  .
.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3026; Нарушение авторских прав?; Мы поможем в написании вашей работы!