
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распределение энергии по степеням свободы
|
|
|
|
Среднее значение энергии одной молекулы  . Если бы мы посчитали отдельно
. Если бы мы посчитали отдельно  , то получили бы величину ровно в три раза меньшую, чем полная энергия. Такие же значения и для
, то получили бы величину ровно в три раза меньшую, чем полная энергия. Такие же значения и для  .
.
Таким образом, если вы молекула могла двигаться только вдоль оси  , ее средняя энергия была бы
, ее средняя энергия была бы  . Говорят, что у молекулы, которая может совершать только одномерные движения – одна степень свободы:
. Говорят, что у молекулы, которая может совершать только одномерные движения – одна степень свободы:  . Это значит. Что нужна только одна переменная, чтобы описать движение частицы. Для материальной точки таких переменных нужно 3:
. Это значит. Что нужна только одна переменная, чтобы описать движение частицы. Для материальной точки таких переменных нужно 3:  . Если же молекула может еще и вращаться, то число степеней свободы увеличивается. Средняя энергия, приходящаяся на одну степень свободы вращательного движения, а также на одну колебательную степень свободы (как потенциальной, так и кинетической) равна
. Если же молекула может еще и вращаться, то число степеней свободы увеличивается. Средняя энергия, приходящаяся на одну степень свободы вращательного движения, а также на одну колебательную степень свободы (как потенциальной, так и кинетической) равна  .
.
Теорема о равнораспределении энергии по степеням свободы: на все степени свободы статистической системы приходится одна и та же энергия  . Это не относится к потенциальной энергии системы во внешних полях.
. Это не относится к потенциальной энергии системы во внешних полях.
Средняя энергия одной молекулы  , где число степеней свободы
, где число степеней свободы 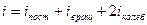 .
.
 Расхождение теории теплоемкости идеального газа с экспериментом.
Расхождение теории теплоемкости идеального газа с экспериментом.
Например, для некоторого количества идеального газа: 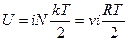 , его молярная теплоемкость
, его молярная теплоемкость 
Для двух атомных молекул всего может быть 3-поступательных, 2-вращательных, 1-колебательная степени свободы. По расчетам для водорода (идеального газа) теплоемкость не зависит от температуры 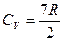 .
.
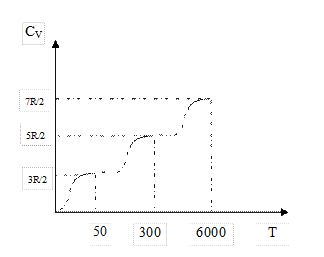
Зависимость теплоемкости молекулярного водорода от температуры, полученная в ходе экспериментов, дается на графике 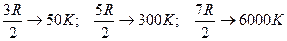 .
.
Молекула водорода ведет себя при низкой температуре как точечная частица, у которой отсутствуют внутренние движения, при нормальной температуре – как жесткая гантель и наряду с поступательным движением также совершает вращательные движения, а при очень высокой температуре к этим движениям добавляются также колебательные движения атомов, входящих в молекулу. Объяснить эту зависимость классической теории не удалось.
Отличие экспериментальной кривой от теоретической прямой имеет квантовое объяснение. При низких температурах вращательные и колебательные степени свободы «выключены», т.е. они не возбуждаются. При температурах ~116К могут возбуждаться вращательные степени свободы, а при температурах ~ 4100К возбуждаются и колебательные степени свободы. Однако переход от одного режима движения к другому происходит не скачком при определенной температуре, а постепенно в некотором интервале температур. Это объясняется тем, что при определенной температуре возникает лишь возможность перехода молекул в другой режим движения, но эта возможность не реализуется сразу всеми молекулами, а лишь их частью.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 383; Нарушение авторских прав?; Мы поможем в написании вашей работы!