
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Москва, 2007
|
|
|
|
Учебно-методические материалы к практическим занятиям
ПАТОФИЗИОЛОГИИ СИСТЕМЫ КРОВИ
ПО ПАТОФИЗИОЛОГИИ НАРУШЕНИЙ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ И
АЛГОРИТМЫ И ПРИМЕРЫ РЕШЕНИЯ КЛИНИЧЕСКИХ ЗАДАЧ
Заключение
Непрерывное взаимодействие человека с живой и неживой природой реализуется через потоки масс веществ, энергии и информации. В тех случаях, когда эти потоки превышают предельно допустимые уровни своих значений, они приобретают способность причинять ущерб здоровью человека, наносить вред природе, разрушать материальные ценности и становятся опасными для окружающего их мира. Источники опасности имеют естественное, антропогенное или техногенное происхождение.
Мир опасностей в начале 21 века достиг своего наивысшего развития. Многообразие и высокие уровни опасностей, действующих на человека, характерны, прежде всего, для техносферы. Непрерывно нарастающие ухудшения здоровья и гибель людей от воздействия опасностей техносферы объективно требует от государства и общества принятия широких мер с использованием научного подхода в решении проблем безопасности жизнедеятельности человека в условиях техносферы.
Достижение приемлемого уровня безопасности в системе «человек-среда обитания» неразрывно связано с необходимостью глубокого анализа причин роста численности и уровня действующих в техносфере опасностей; изучение причин принудительной потери здоровья и гибели людей; разработки и широкого применения превентивных защитных мер на производстве, в быту и в регионах техносферы. Важную роль в сохранении здоровья и жизни людей в настоящем и будущем призвана играть информационная деятельность государства в области прогнозирования опасностей среды обитания. Компетентность людей в мире опасностей и способы защиты от них - необходимое условие достижения безопасности жизнедеятельности человека на всех этапах его жизни.
по темам:
«Патофизиология кислотно-основного состояния»,
«Патофизиология системы крови»
ПАТОФИЗИОЛОГИЯ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
ВВЕДЕНИЕ
Как известно, рН (pover Hydrogen – «сила водорода») представляет собой отрицательный десятичный логарифм от концентрации водородных ионов в растворе. Так, например, если рН = 7.0, то это означает, что концентрация водородных ионов равна 1/10000000 (10-7) эквивалента в литре. В случае водорода, один грамм равен одному эквиваленту и таким образом при рН = 7.0 в литре раствора содержится 0.0000001 г. водорода. Соответственно, например, при рН =8.0 в литре раствора содержится 0.00000001 г. водорода и т.д.
pH крови – одна из самых жестких физиологических констант. В норме этот показатель может меняться в пределах от 7.36 – 7.42. Сдвиг pH на 0.1 по сравнению с физиологической нормой уже способен привести к тяжелой патологии. При сдвиге рН крови на 0.2 может развиться коматозное состояние, на 0.3 – организм гибнет.
ОСНОВНЫЕ ПОКАЗАТЕЛИ КОС.
1. Актуальный (истинный pH) – это значение pH артериальной крови, определенное без доступа воздуха при температуре 37о С.
2. Актуальное (истинное) парциальное напряжение углекислого газа (рСО2) – это значение рСО2 артериальной крови, определенное без доступа воздуха при температуре 37о С.
3. Стандартный бикарбонат (SB – “Standart Bicarbonat”) – это содержание бикарбонатов в плазме крови (ммоль/л) при полном насыщении ее кислородом и при рСО2, равном 40 мм ртутного столба, определяемое при температуре 37о С.
4. Актуальный (истинный) бикарбонат (АВ – “Actual Bicarbonat”) – концентрация бикарбоната в плазме крови (в ммоль/л) при истинном рСО2 , определяемом при температуре 37о С.
5. Избыток (недостаток) буферных оснований (ВЕ – “Base Excess”) – разность между средним нормальным содержанием буферных оснований (в цельной крови при pH = 7.40 и рСО2, равном 40 мм.рт.ст.) и найденным значением концентрации буферных оснований.
НОРМАЛЬНЫЕ ЗНАЧЕНИЯ ОСНОВНЫХ ПОКАЗАТЕЛЕЙ КОС АРТЕРИАЛЬНОЙ КРОВИ.
| ПОКАЗАТЕЛИ | ЗНАЧЕНИЯ |
| pH | Муж. 7.36-7.42; женщ. 7.37-7.42 |
| pСО2 (мм.рт.ст.) | Муж. 35.8- 46.6; женщ. 32.5-43.7 |
| SB | 21.3-24.8 ммоль/л |
| AB | 18.8-24.0 ммоль/л |
| BE | Муж.-2.4-+2.3; женщ. –3.3 - +1.2 |
НОРМАЛЬНЫЕ ЗНАЧЕНИЕ НЕКОТОРЫХ ДОПОЛНИТЕЛЬНЫХ ПОКАЗАТЕЛЕЙ КРОВИ И МОЧИ, ОТРАЖАЮЩИХ КОС.
| ПОКАЗАТЕЛИ | ЗНАЧЕНИЯ |
| Молочная кислота крови | 0.9 – 1.75 ммоль/л |
| Кетоновые тела крови | 0.4 – 1.72 ммоль/л |
| ТК (титрационная кислотность суточной мочи) | 10-30 мл щелочи |
| Аммиак мочи (NH4+) | 20-50 ммоль/л |
БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА.
Карбонатная буферная система. Она определяется постоянством соотношения угольной кислоты и ее кислой соли, например: H2CO3/NaHCO3. Данное соотношение постоянно поддерживается в пропорции 1/20. В том случае, если в организме образуется или в него поступает сильная кислота (рассмотрим такую ситуацию с участием HCI) происходит следующая реакция:
NaHCO3 + HCI ¬® NaCI + Н2СО3
При этом избыток хлористого натрия легко выделяется почками, а угольная кислота под влиянием фермента карбоангидразы распадается на воду и углекислый газ, избыток которого быстро выводится легкими.
При поступлении во внутреннюю среду организма избытка щелочных продуктов (рассмотрим на примере с NaOH) реакция идет по-другому:
Н2СО3 + NaOH ¬® NaHCO3 + Н2О
Уменьшение концентрации угольной кислоты компенсируется снижением выведения углекислого газа легкими.
Фосфатная буферная система действует за счет поддержания постоянтства соотношения одно- и двуметаллической соли фосфорной кислоты. В случае натриевых солей (дигидрофосфата и гидрофосфата натрия) это соотношение выглядит следующим образом: NaH2PO4 / Na2HPO4. Данное соотношение поддерживается в пропорции 1/4.
При взаимодействии этой системы с кислыми продуктами образуется дигидрофосфат натрия и хлористый натрий:
Na2HPO4 + HCI ¨NaH2PO4+NaCI
А при реакции со щелочными продуктами образуется однозамещенный гидрофосфат натрия и вода.
Na2HPO4+ NaOH ¬®Na2HPO4+ Н2О
Избытки продуктов обоих реакций удаляются почками.
Белковая буферная система способна проявлять свои свойства за счет амфотерности белков, которые в одном случае реагируют со щелочами как кислоты (в результате реакции образуются щелочные альбумины), а в другом – с кислотами как щелочи (с образованием кислых альбуминов) В целом, во весьма схематичном виде, эту закономерность можно проиллюстрировать следующим образом:
 СООН + NaOH ® СООNa + Н2О
СООН + NaOH ® СООNa + Н2О
 БЕЛОК
БЕЛОК
NН2 + HCI ® NН4 CI
Гемоглобиновая буферная система в значительной степени обеспечивает буферную емкость крови. Это связано с тем, что оксигемоглобин (HbО2) является гораздо более сильной кислотой, чем восстановленный гемоглобин (Hb). В венозных капиллярах в кровь поступает большое количество кислых продуктов распада, она обогащается углекислым газом, что сдвигает ее реакцию в кислую сторону. Но одновременно в этих же участках микроциркуляторного русла происходит восстановление гемоглобина, который, становясь при этом более слабой кислотой, отдает значительную часть связанных с ним щелочных продуктов. Последние, реагируя с угольной кислотой, образуют бикарбонаты.
СВЯЗЬ МЕХАНИЗМОВ ПОДДЕРЖАНИЯ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
(по Майкл А. Гриппи, 1997)
Схема, иллюстрирующая транспорт углекислого газа, образование бикарбонатов, хлорный сдвиг и связывание ионов водорода в тканевых капиллярах (в легочных капиллярах при поглощении кислорода и выделении углекислого газа данная реакция протекает в обратном порядке).
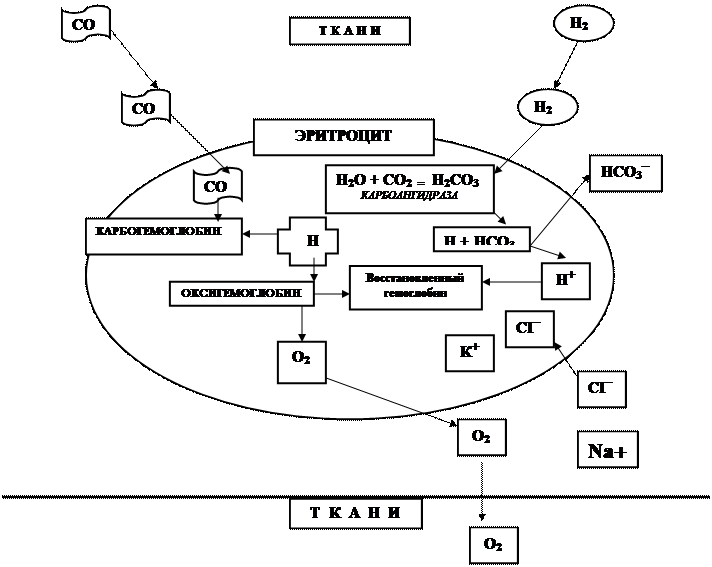
ТРАНСПОРТ УГЛЕКИСЛОГО ГАЗА, ОБРАЗОВАНИЕ БИКАРБОНАТОВ, СВЯЗЫВАНИЕ ИОНОВ ВОДОРОДА.
В артериальной крови основное количество двуокиси углерода (90%) содержится в виде бикарбоната, который образуется за счет реакции углекислого газа с водой (образование Н2СО3) и последующей диссоциацией на катион водорода и анион НСО3. Эта реакция чрезвычайно быстро протекает в эритроцитах под влиянием внутриклеточного фермента карбоангидразы.
Анион НСО3 свободно проходит через клеточную мембрану и накапливается в плазме крови, образуя бикарбонат натрия.
Катионы водорода, как и любые другие катионы, плохо проходят через мембрану эритроцита и накапливаются в клетке. Их избыток ликвидируется за счет соединения с восстановленным гемоглобином. Последний образуется в тканевых капиллярах после отсоединений кислорода и диффузии его в ткани.
С другой стороны, электрическая нейтральность клетки обеспечивается диффузией в эритроцит анионов хлора (так называемый хлоридный сдвиг).
Незначительная часть двуокиси углерода транспортируется из тканевых в легочные капилляры за счет соединения с гемоглобином (в форме карбогемоглобина).
При компенсации нарушений КОС буферные системы эритроцитов, плазмы и межклеточной жидкости реагируют как единое целое, так как:
· Буферные возможности крови распределены почти поровну между плазмой и эритроцитами.
· В клетках наибольшее значение имеют буферные свойства гемоглобина, на втором месте стоит бикарбонат.
· В плазме, наоборот – бикарбонат стоит на первом месте, а белки на втором.
· В межклеточной (интерстециальной) жидкости, которая функционально связана с кровью, содержится только бикарбонатный буфер. (Его концентрация примерно в 2 раза меньше, чем в плазме, но поскольку межклеточной жидкости примерно в 2 раза больше, чем крови, их суммарные буферные возможности оказываются одинаковыми).
КЛАССИФИКАЦИЯ НАРУШЕНИЙ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ.
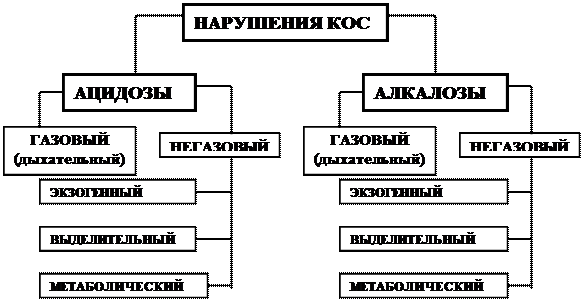
ТИПОВЫЕ ФОРМЫ НАРУШЕНИЙ КОС.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 410; Нарушение авторских прав?; Мы поможем в написании вашей работы!