
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Межмолекулярные связи
|
|
|
|
Сравнение МВС и ММО
Оба метода имеют общие положения:
1) они дают одинаковое распределение электронной плотности в соединениях;
2) связь образуется за счет перекрывания АО, причем прочность связи растет с увеличением электронной плотности в области связи;
3) в зависимости от типа АО образуются s-, p- и δ- связи.
Метод ММО более универсален, может объяснить характер связей у более широкого круга соединений, более приспособлен для машинных расчетов, однако он более сложен, менее нагляден и более формален.
К основным видам межмолекулярного взаимодействия относят вандерваальсовы силы, водородные связи и донорно-акцепторные взаимодействия.
Вандерваальсовы силы обуславливают притяжение межу молекулами и включают в себя три составлющие: диполь- дипольное взаимодействия, индукционное и дисперсионное взаимодействия.
1. Диполь- дипольное взаимодействие происходит за счет ориентации диполей:

 2. Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:
2. Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:





 3. Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
3. Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
 |  | ||||||
 | |||||||
 | |||||||
Энергия вандерваальсовых взаимодействий невелика и выражается уравнением: 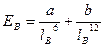 , где a и b - константы, lB - расстояние между молекулами, Ев - энергия.
, где a и b - константы, lB - расстояние между молекулами, Ев - энергия.
Водородная связь - это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К).
Энергия и длина водородной связи. Энергия возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов. Водородная связь более прочная, чем вандерваальсово взаимодействие, но менее прочная, чем ковалентная связь. Аналогичную зависимость имеет и длина связи.





 Н 0,036 О Н 0,177 О
Н 0,036 О Н 0,177 О
 О + Н Н = О......Н Н
О + Н Н = О......Н Н
Н Н
F–H + F- = [ F–H…H ]–
0.092 0.126
Водородные связи очень распространены, так как многие соединения содержат ковалентные полярные связи Н-О и Н-N, например, вода, кристаллогидраты, белки. Многие физические свойства веществ с водородной связью выпадают из общего хода их изменения в ряду атомов. Так, летучесть ассоциированных аномальна мала, а вязкость, диэлектрическая постоянная, теплота парообразования, температура кипения аномально повышенные. В ряду H2O – Н2S - Н2Se – H2Te свойства воды резко отличаются от свойств других веществ. Если бы вода не обладала водородными связями, она имела бы температуру плавления не 0°С, а (-100°С), и температуру кипения не 100°С, а -80°С. Водородная связь влияет и на химические свойства веществ. Так, HF - слабая кислота, тогда как НС1 - сильная. Причина в том, что HF образует с помощью водородной связи дифторид-ионы и другие более сложные ассоциаты.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 441; Нарушение авторских прав?; Мы поможем в написании вашей работы!