
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы связей между атомами и молекулами
|
|
|
|
Материаловедение как научная дисциплина
Лекция 1. Строение и свойства материалов
Материаловедение – наука, изучающая взаимосвязь между составом, строением и свойствами материалов. Целью освоения дисциплины студентами является изучение состава, строения, свойств материалов и способов их изменения в желательном направлении с помощью термической, химико-термической и других видов обработки.
В материаловедении используются многочисленные методы исследования материалов:
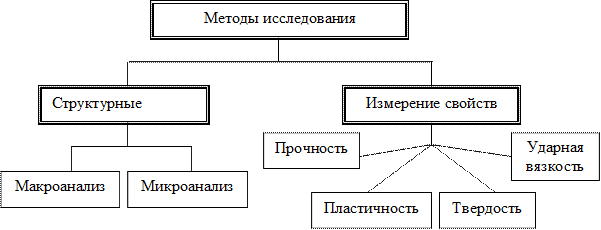
К главным из них относятся ионная, ковалентная, молекулярная и металлическая.
Первые два типа связи образуются за счет перераспределения электронной плотности. При этом в случае ковалентной неполярной связи валентные электроны просто обобществляются между соседними атомами ( , алмаз), а в случае ковалентной полярной (
, алмаз), а в случае ковалентной полярной (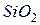 ) и, особенно, ионной (
) и, особенно, ионной (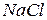 ) дополнительно происходит смещение электронной плотности к атому более электроотрицательного элемента (от
) дополнительно происходит смещение электронной плотности к атому более электроотрицательного элемента (от 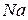 к
к  ). Эти два типа связи направленные, т.к. каждый атом вступает в обменное взаимодействие с вполне определенным числом соседних атомов. Следствием этого является низкая пластичность и, соответственно, высокая хрупкость. К характерным свойствам также относятся высокая твердость, высокая температура плавления и сублимации, высокий модуль упругости и низкие коэффициенты сжимаемости и теплового расширения. Отсутствие свободных носителей электричества, поскольку поляризованные атомы включены в состав кристаллической решетки, а валентные электроны находятся на электронных орбитах атомов, делает кристаллы данных типов диэлектриками.
). Эти два типа связи направленные, т.к. каждый атом вступает в обменное взаимодействие с вполне определенным числом соседних атомов. Следствием этого является низкая пластичность и, соответственно, высокая хрупкость. К характерным свойствам также относятся высокая твердость, высокая температура плавления и сублимации, высокий модуль упругости и низкие коэффициенты сжимаемости и теплового расширения. Отсутствие свободных носителей электричества, поскольку поляризованные атомы включены в состав кристаллической решетки, а валентные электроны находятся на электронных орбитах атомов, делает кристаллы данных типов диэлектриками.
В молекулярных кристаллах преобладает связь Ван-дер-Ваальса. Она основана на взаимодействии имеющихся или образовании наведенных диполей.
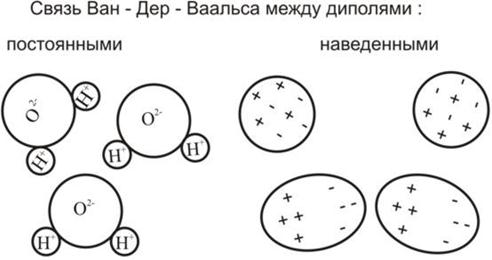
Энергия связи сил Ван-дер-Ваальса невелика, поэтому молекулярные кристаллы имеют низкие температуры плавления и испарения. Например, кристаллический йод испаряется уже при комнатных температурах. Молекулярные кристаллы – диэлектрики, так как построены из электрически нейтральных атомов (молекул).
В металлическом кристалле валентные энергетические зоны атомов перекрываются, образуя общую зону со свободными подуровнями, что дает возможность валентным электронам свободно перемещаться в пределах этой зоны от атома к атому (т.н. электронный газ). Все наиболее характерные свойства металлов объясняются наличием в них легкоподвижных коллективизированных электронов проводимости. Металлическая связь в отличие от остальных типов связи ненаправленная, поэтому каждый атом стремится притянуть к себе как можно больше соседних атомов. Ненаправленность связи делает возможной пластическую деформацию, поскольку при этом только меняются соседи атома по кристаллической решетке.
Энергия металлической связи несколько меньше, чем ковалентной, поэтому металлы, по сравнению с ковалентными кристаллами, имеют более низкие температуры плавления, сублимации, но более высокий коэффициент теплового расширения.
Прочность металлов в большинстве случаев высокая и особенно велика у переходных металлов, что объясняется участием в образовании связи не только 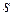 - электронов, но и части электронов
- электронов, но и части электронов 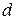 - подуровня. Это сказывается в повышении как прочности, так и температуры плавления.
- подуровня. Это сказывается в повышении как прочности, так и температуры плавления.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 759; Нарушение авторских прав?; Мы поможем в написании вашей работы!