
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические основы процесса ожижения газов
|
|
|
|
Установки глубокого холода.
Согласно классификаци в холодильной технологии (см. лекцию 7) к установкам глубокого холода относятся такие, в которых температура хладоагента в холодильной камере ниже 120К.
Назначение таких установок – перевести смесь веществ из газообразного состояния в жидкое. Далее, эта жидкость направляется на разделение с целью получения чистых компонент смеси. Например, природный газ ожижают для отделения ценных компонент (в частности, Не), а оставшаяся жидкая смесь углеводородов транспортируется или по трубопроводам, или в специальных сосудах Дюара на кораблях или наземным транспортом. В целом такой способ транспортировки природного газа потребителю сегодня оказался дешевле, чем трубопроводный газотранспорт.
Эти основы легко уяснить, если ответить на вопрос: «В чем отличие молекулярного состояния вещества в жидкой и газообразной фазе?». Прежде всего, ясно, что среднее расстояние l между молекулами газа много больше, чем между молекулами жидкости. Следовательно, для перевода газа в жидкость необходимо сблизить молекулы вещества, т.е. увеличить плотность ρ(р,Т), кг/м3, т.е. увеличить давление р.
Другое отличие состояния молекул вещества в газовой и жидкой фазах – большие линейные скорости поступательного хаотического движения молекул газа, это что-то около скорости звука. Следовательно, для ожижения газа необходимо не только сблизить молекулы, но и уменьшить внутреннюю энергию газа, т.е. отвести теплоту. А если этот процесс отвода теплоты изобарный (как во всяком теплообменнике), то отвод теплоты приводит к уменьшению температуры.
Итак: чтобы ожижить любой газ (или их смесь), необходимо создать высокое давление и охладить его.
Молекулы любого реального вещества испытывают силовое взаимодействие между собой. Это или силы отталкивания, или притяжения. На рис. 8.1 представлена зависимость этих сил от расстояния между молекулами l. Оказывается, при больших l эта сила – сила отталкивания, и она очень мала. Собственно, поэтому модель идеального газа оказалась такой работоспособной: изменение l для газов слабо меняет силу отталкивания (из-за ее малости), поэтому вклад потенциальной энергии взаимного расположения молекул во внутреннюю энергию газа ничтожен.
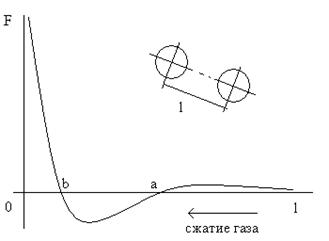
Рис. 8.1. Зависимость силы взаимодействия между молекулами от расстояния между ними.
При сжатии газа (увеличении давления) расстояние l уменьшается, а сила отталкивания сначала растет и далее уменьшается (см. рис. 8.1). При l = a эта сила становится нулевой. При дальнейшем сжатии начинает действовать сила притяжения вплоть до точки l = b. За этой точкой, левее, снова возникает сила отталкивания, которая резко растет с уменьшением l.
Можно показать, что точка l = a является неустойчивой точкой равновесия. Действительно, если расстояние между молекулами слегка увеличилось относительно l = a в силу каких-то случайных причин, то начнет действовать пусть небольшая сила отталкивания, и молекулы «разбегутся» друг от друга. Если же расстояние между молекулами чуть уменьшится относительно l = a, то начнет действовать сила притяжения, и молекулы начнут сближаться друг с другом, но не вернутся в исходное положение l = a.
Те же самые рассуждения позволяют доказать, что точка l = b является устойчивой точкой равновесия: любые малые отклонения расстояния между молекулами от l = b в конце концов приводят к появлению сил, возвращающих их в положение l = b.
Рассмотрение сил взаимодействия между молекулами вещества и точек равновесия позволяет сделать рекомендации для определения минимального расстояния между молекулами (l < a). Если расстояние l удовлетворяет указанному неравенству (т.е. такова степень сжатия газа), то все молекулы газа «прибегут» в точку устойчивого состояния равновесия l = b. Это и будет состояние жидкой фазы вещества.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!