
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации раствора
|
|
|
|
Эквивалентом называют условную или реальную частицу вещества X, которая в данной кислотно-основной реакции эквивалентна одному протону или в данной окислительно-восстановительной реакции - одному электрону.
Концентрацией вещества – компонента раствора – называют величину, измеряемую количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
Химия: Основы химии живого: Учебник для вузов / В.М. Слесарев – СПб. Химиздат. 2001, с.135 – 139.
- выполнить все задания предложенные в данной рекомендации
- пройти контроль знаний
- разобрать и выучить тестовые задания по данной теме.
Начать подготовку к занятию, сначала выучи все новые определения и вспомни те, которые учил в школе:
Фактор эквивалентности (fэкв (X)) – число, обозначающее какая доля реальной частицы вещества (Х) эквивалентна одному протону или одному электрону в данной ОВР (z)/
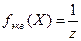
Молярной массой эквивалента вещества Х (масса одного моля эквивалента вещества) называют величину, измеряемую произведением фактора эквивалентности на молярную массу вещества Х.
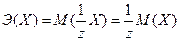
| Наименование | Обозна чение | Единицы измерения | Расчетная формула | Определение | Физический смысл |
| Массовая доля | С, ω | % (проценты, доли единицы) | 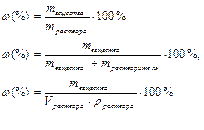
| Отношение массы растворенного вещества к общей массе раствора | Число граммов растворенного вещества в 100 г раствора |
| Молярная концентрация | Cм | моль/л | 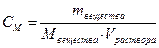
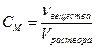
| Отношение количества растворенного вещества к объему раствора | Число моль растворенного вещества в 1 л раствора |
| Молярная концентрация эквивалента, эквивалентная или нормальная концентрация | Сн | моль-экв /л | 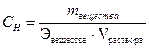 (Э- молярная масса эквивалента)
(Э- молярная масса эквивалента)
| Отношение количества вещества эквивалента растворенного вещества к объему раствора | Число эквивалентов растворенного вещества в 1 л раствора |
| Моляльная концентрация | Сm | моль/кг | 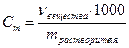
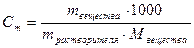
| Отношение количества растворенного вещества к массе растворителя | Число моль растворенного вещества в 1 кг растворителя |
| Титр | Т | г/мл | 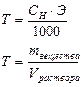
| Отношение массы растворенного вещества к объему раствора | Число граммов растворенного вещества в 1 мл |
| Мольная доля | Ni | - | 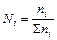
| Отношение количества растворенного вещества (или растворителя) к сумме количества вещества всех компонентов, находящихся в растворе | ΣNi=1 Сумма мольных долей всех компонентов смеси равна 1 |
| Закон эквивалентов | - | - | 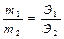
| Массы реагирующих друг с другом веществ, пропорциональны их эквивалентным массам | Вещества взаимодействуют в эквивалентных количествах |
| Следствие из закона эквивалентов | - | - | 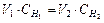
| Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям | Вещества взаимодействуют в эквивалентных количествах |
Разбери и выучи все способы выражения концентрации, которые предложены в таблице. Проверь свои знания, ответив на вопросы. Если затрудняешься, вернись к таблице.
- Дайте определение массовой доли.
- Что показывает молярная концентрация? (Каков её физический смысл?)
- Как рассчитать молярную массу эквивалента соляной кислоты?
 Проверка знаний теории.
Проверка знаний теории.
Выберите правильный ответ из предложенных в скобках и вставьте его. Подобный вид заданий подготовит Вас к работе с тестовыми заданиями.
- Массовая доля, как способ выражения концентрации растворенного вещества в растворе – это отношение массы растворенного вещества к массе ______________ (растворителя, раствора, воды). Массовая доля может выражаться в процентах (%) или долях от единицы. Если массовая доля растворенного вещества в растворе выражена в процентах, то она всегда _________________ (больше, меньше, равна) 100%.
- Молярная концентрация растворенного вещества в растворе прямо пропорциональна _________________ (объему раствора, молярной массе растворенного вещества, массе растворенного вещества в растворе). Молярная концентрация или молярность и процентная концентрация _______________ (иногда, никогда) численно не совпадают.
- Нормальная концентрация или молярная концентрация эквивалента растворенного вещества в растворе – это отношение числа моль эквивалентов растворенного вещества к ____________ (объему, массе, плотности) раствора. Если молярная масса эквивалента растворенного вещества совпадает с его молярной массой, то молярная концентрация растворенного вещества в растворе ______________ (больше, меньше, равна) его нормальной концентрации.
- Мольная доля растворенного вещества в растворе – это _____________ (разность, отношение, произведение) количества растворенного вещества _______________ (и общего числа, к общему числу) моль в растворе.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2348; Нарушение авторских прав?; Мы поможем в написании вашей работы!