
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диференціали від термодинамічних потенціалів
|
|
|
|
Спряжені термодинамічні змінні
Термодинамічні потенціали
Розвиток термодинаміки увінчався розробкою понять термодинамічних потенціалів, які є основою сучасного розуміння термодинамічних явищ. Основних термодинамічних потенціалів чотири: внутрішня енергія, вільна енергія, ентальпія, вільна енергія Гібса. Ці чотири потенціали визначені для закритої системи, яка не може обмінюватися речовиною з оточенням. У випадку відкритої системи й систем у зовнішніх полях можлива побудова інших потенціалів за аналогією із зазначеними 4-ма потенціалами.
Усі термодинамічні змінні можна об'єднати у пари спряжених. Одна змінна із пари може розглядатися для певного виду процесу дією, а інша відгуком на цю дію. Так, наприклад, газ можна розширювати чи стискати, фіксуючи об'єм, вимірюючи при цьому зміну тиску як відгук на зміну об'єму. З іншого боку, можна змінювати зовнішнійтиск і цікавитися зміною об'єму.
Основні пари спряжених змінних наведені в наступній таблиці
| Змінна | Спряжена змінна |
| Температура | Ентропія |
| Об'єм | Тиск |
| Кількість частинок | Хімічний потенціал |
| Тензор деформації | Тензор механічних напружень |
Із першого закону термодинаміки для закритої термодинамічної системи випливає, що малий приріст внутрішної енергії можна записати у вигляді
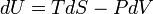 ,
,
де T - температура, S - ентропія, P - тиск, V - об'єм. Член  описує кількість теплоти, наданої термодинамічній системі. Внутрішня енергія, як термодинамічний потенціал закритої системи є функцією ентропії та об'єму. Спряжені до ентропії та об'єму змінні - термпература та тиск є коефіцієнтами при диференціалах, а отже дорівнюють з точністю до знаку похідним від термодинамічного потенціалу по відповідній змінній.
описує кількість теплоти, наданої термодинамічній системі. Внутрішня енергія, як термодинамічний потенціал закритої системи є функцією ентропії та об'єму. Спряжені до ентропії та об'єму змінні - термпература та тиск є коефіцієнтами при диференціалах, а отже дорівнюють з точністю до знаку похідним від термодинамічного потенціалу по відповідній змінній.
Інші термодинамічні потенціли можна отримати, додаючи чи віднімаючи добуток спряжених змінних. Так, наприклад

задає новий потенціал - вільну енергію, яка є функцією температури та об'єму.
Похідна від вільної енергії по об'єму при сталій температурі визначає тиск, як функцію температури та об'єму, тобто задає рівняння стану:
 .
.
Таким чином, при побудові теоретичної моделі термодинамічної системи, знахождення виразу для вільної енергії визначає всі характеристики системи.
Другі похідні від термодинамічних потенціалів дозволяють визначити інші важливі характеристики термодинамічних систем, наприклад теплоємність, стисливість
Другий закон термодинаміки
Другий закон термодинаміки є твердженням про те, що термодинамічна система прагне до збільшення ентропії. Адіабатична нерівноважна система, тобто система, яка не може обмінюватися теплом із навколишнім середовищем, еволюціонує з часом, переходячи із одного стану в інший, доки не досягне рівноважного стану. Другий закон термодинаміки стверджує, що при такій еволюції значення ентропії може лише зростати: 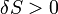 . В рівноважному стані ентропія має максимальне значення. Якщо термодинамічна система може обмінюватися теплом із навколишнім середовищем, то
. В рівноважному стані ентропія має максимальне значення. Якщо термодинамічна система може обмінюватися теплом із навколишнім середовищем, то  , причому рівність досягається тільки для рівноважного процесу.
, причому рівність досягається тільки для рівноважного процесу.
Виходячи із статистичної інтерпретації термодинаміки закон неспадання ентропії відповідає переходу системи із менш імовірного стану в більш імовірний, тобто із макроскопічного стану, якому відповідає менша кількість мікроскопічних станів, у макроскопічний стан, якому відповідає більша кількість мікроскопічних станів. Висловлюючись простіше, термодинамічна система прагне перейти від більш упорядкованого стану до стану із більшим безпорядком.
Наслідком другого закону термодинаміки є неможливість перетворення всього тепла у роботу, що заперечує можливіть побудови вічного двигуна другого роду. Максимально можливий коефіцієнт корисної дії теплової машини досягається в циклі Карно і визначається формулою:
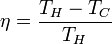
де 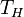 - температура нагрівача,
- температура нагрівача, 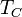 - температура охолоджувача.
- температура охолоджувача.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 512; Нарушение авторских прав?; Мы поможем в написании вашей работы!