
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Фрейндлиха
|
|
|
|
Уравнение Дубинина – Радушкевича
где 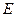 – постоянная для каждого адсорбента.
– постоянная для каждого адсорбента.
n = 1 – крупнопористый адсорбент;
n = 2 – активные угли;
n = 3 - цеолиты – молекулярные сита, ультромикропористые адсорбенты.
Теоретические представления, развитые Лэнгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г.Фрейндлих предположил, что число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (удельная адсорбция x/m) должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенной в некоторую степень, которая всегда меньше единицы:
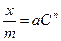 или
или 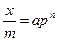 - уравнение Фрейндлиха
- уравнение Фрейндлиха
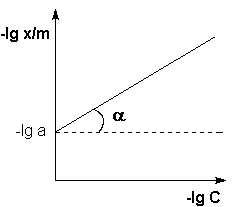
Рис. 13. Изотерма адсорбции Фрейндлиха.
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения, получаем:
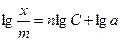 и
и 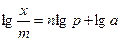
Таким образом, зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации:
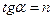 .
.
Теория полимолекулярной адсорбции БЭТ
Теория БЭТ создана в попытке обобщить представления Ленгмюра и Поляни и описать изотермы различной формы с помощью одного уравнения. Теория была развита Брунауэром, Эммером и Теллером в 1935 – 1940 г.г.
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует избыточную поверхностную энергию, и влияние поверхностных сил распространяется на второй и следующие слои. Полимолекулярную адсорбцию рассматривают как результат вынужденной конденсации пара под действием поверхностных сил.
Основные положения теории БЭТ сводятся к следующему:
1. На поверхности адсорбента имеется определённое число равноценных в энергетическом отношении центров, способных удерживать молекулы адсорбтива.
2. Для простоты взаимодействием адсорбированных молекул в первом и последующих слоях пренебрегают. Оба эти допущения соответствуют ленгмюровской адсорбции на однородной поверхности без взаимодействия адсорбированных молекул.
3. Каждая молекула первого слоя представляет собой возможный центр для адсорбции во втором слое; каждая молекула второго слоя является возможным центром адсорбции в третьем и т.д.
4. Адсорбированная фаза может быть представлена как совокупность молекулярных цепочек, начинающихся молекулами первого слоя, причем цепочки энергетически не взаимодействуют друг с другом.
Итак, адсорбция считается послойной. Молекулы первого слоя адсорбируются на поверхности адсорбента – межмолекулярное взаимодействии адсорбент - адсорбат, которая определяется теплотой адсорбции q1. 2–ой слой определяется теплотой адсорбции равной теплоте конденсации λ, характер взаимодействия адсорбат – адсорбат.
Было составлено уравнение адсорбционного равновесия для каждого слоя и просуммировано:
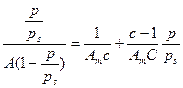 - уравнение для полимолекулярной адсорбции
- уравнение для полимолекулярной адсорбции
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1932; Нарушение авторских прав?; Мы поможем в написании вашей работы!