
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория ДЛФО – теория устойчивости и коагуляции
|
|
|
|
Факторы устойчивости коллоидных систем
1. Электростатический фактор – уменьшение межфазного натяжения веществами вследствие возникновения ДЭС на поверхности частиц, обуславливается электролитической диссоциацией или адсорбцией электролитов, особенно для лиозолей в полярной среде.
2. Адсорбционно–сольватный фактор – уменьшение межфазного натяжения при взаимодействии частиц дисперсной фазы со средой благодаря адсорбции и сольватации.
Чем выше сольватация, тем выше устойчивость, т.к. молекулы сольвента адсорбируясь на поверхности частиц дисперсной фазы, препятствуют их слипанию.
В соответствие с теорией Пескова основная причина устойчивости коллоидных систем связана с процессом адсорбции молекул растворителя на поверхности частиц.
3. Энтропийный фактор – стремление дисперсной фазык равномерному распределению оп объему системы.
4. Структурно–механический фактор – при добавлении к дисперсной системе ПАВ или ВМС, адсорбирующихся на поверхности раздела, образуются адсорбционные слои ВМС или ПАВ. Они обладают упругостью и механической прочностью, что предотвращает слипание частиц.
5. Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсионной среды и дисперсной фазы.
Разработана учёными Б.В. Дерягин и Л.Д. Ландау в 1937 – 1941 гг. и позже независимо от них голландскими учёнными Фервеем и Овербеком.
Теория удовлетворительно описывает закономерности поведения типично лиофобных дисперсных систем, для которых можно пренебречь адсорбционно-сольватным фактором устойчивости.
В соответствии теорией ДЛФО все частицы взаимодействую друг с другом, следующим образом:
1. Между частицами существуют силы отталкивания, имеющие электростатическую природу. Эти силы не проявляются на значительном расстоянии друг от друга. Когда диффузные слои перекрываются, возникает электростатической взаимодействие между противоионами и происходит перераспределение. Природа сил отталкивания при сближении мицелл сложнее, чем просто кулоновское взаимодействие.
Дерягин показал, что здесь проявляются силы особого рода, называемые расклинивающим давлением (силы отталкивания) – возникает при сильном уменьшении толщины слоя в результате перекрывания поверхностных слоёв.
Дерягин вычислил зависимость энергии отталкивания от расстояния между частицами, взяв за основу систему расчетов для двух пластин:
 ,
,
где  l – расстояние между частицами; С – концентрация электролита; δ – толщина диффузного слоя; R – универсальная газовая постоянная; γ – параметр, зависящий от потенциала частиц, рассчитывается по формуле:
l – расстояние между частицами; С – концентрация электролита; δ – толщина диффузного слоя; R – универсальная газовая постоянная; γ – параметр, зависящий от потенциала частиц, рассчитывается по формуле:
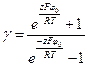
Энергия электростатического отталкивания может быть также рассчитана по следующей формуле:
 ,
,
где χ – обратная величина толщины диффузного ДЭС; h – расстояние между частицами, h=2l;
2. Силы притяжения между частицами (Ван-дер-Ваальсовы силы). Возникновение таких сил обусловлено:
а) взаимодействием диполей - эффект Кеезома – если молекулы полярны, их дипольный момент описывается по формуле
μ=ql,
где q – величина эффективного заряда, l – расстояние между центрами тяжести положительного и отрицательного заряда в молекуле,
то энергия взаимодействия между диполями – энергия ориентационного взаимодействия – описывается формулой:
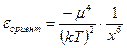 ,
,
где х – расстояние между диполями.
б) поляризацией одной молекулы другой - эффект Дебая - наблюдается при взаимодействии между диполем и индуцированным диполем – возникает под действием стабильного диполя, называется энергией индукционного взаимодействия:
 ,
,
где х – расстояние между диполями; α – поляризуемость частицы.
в) взаимодействием мгновенных и индуцированных моментов – эффект Лондона – обусловлено электронными переходами, называется энергией дисперсионного взаимодействия:
 ,
,
где h – постоянная Планка; ν – волновое число; х – расстояние между диполями; α – поляризуемость частицы.
В общем случае электрическое межмолекулярное взаимодействие определяется:

Поскольку коллоидная частица имеет определённый размер, то ДЭС можно представить как плоский, тогда
 ,
,
где А – Ван-дер-ваальсовская постоянная – константа Гамакера, учитывает природу взаимодействующих частиц, выражается в единицах энергии и имеет значение порядка 10-19 Дж.
При сближении частиц ионно-стабилизированных золей баланс возникающих сил отталкивания и Ван-дер-ваальсовых (межмолекулярных) сил притяжения определяет суммарную потенциальную энергию взаимодействия частиц.

Уравнение справедливо для случая, когда толщина ДЭС меньше радиуса частиц, т.е. поверхность может рассматриваться как плоская.
 |
Рис. 19. Зависимость Uотт, Uприт и суммарной потенциальной энергии U от расстояния между частицами h.
При сближении частиц энергия притяжения резко возрастает, а суммарная потенциальная энергия на некотором расстоянии между частицами проходит через max. Umax – потенциальный бартер отталкивания, который характеризует агрегативную устойчивость золя.
При увеличении концентрации электролита силы электростатического отталкивания уменьшается вследствие сжатия диффузных ДЭС частиц и потенциальный барьер отталкивания Umax снижается.
 |
Рис. 20. Потенциальные кривые, характеризующие изменение энергии взаимодействия U двух коллоидных частиц от расстояния между их поверхностями h.
Кривая 1 – агрегативно устойчивый золь: потенциальный барьер отталкивания Umax достаточно высок, так что кинетической энергии при их столкновении недостаточно для его преодоления – коагуляция отсутствует.
Кривая 2 и 3 – концентрация электролита увеличивается. По мере увеличения концентрации электролита Umax снижается, доля эффективных соударений растёт и скорость коагуляции увеличивается - медленная коагуляция.
Кривая 4 отвечает наступлению быстрой коагуляции Umax =0, при любых расстояниях преобладают силы притяжения. Все столкновения эффективны, скорость коагуляции предельна.
Таким образом, скорость коагуляции зависит от интенсивности коагулирующего воздействия: концентрация электролита, заряд коагулирующих ионов и др.
 |
Рис. 21. Зависимость начальной скорости коагуляции от концентрации электролита-коагулянта.
Вначале с увеличением концентрации скорость коагуляции растёт – медленная коагуляция, затем скорость перестаёт зависеть от концентрации электролита – быстрая коагуляция. Ск – концентрация электролита, при которой происходит переход от медленной к быстрой коагуляции, называется ПБК – порогом быстрой коагуляции.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 8467; Нарушение авторских прав?; Мы поможем в написании вашей работы!