
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Плавление и кристаллизация
|
|
|
|
Плавлением называется переход твердых тел в жидкие при определенной, зависящей от давления, температуре.
Установлено, что в жидком металле хотя и нет дальнего порядка в расположении атомов как в кристаллах, но существует ближний порядок в пространственном расположении атомов.
Установлено, что в металлах при расплавлении координационное число по существу не является пространственно постоянным.
Число ближайших соседей произвольно выбранного атома в жидкости можно рассматривать как среднее по времени и объему, оно может меняться вследствие движения и перемещения атомов в расплаве. В отдельные промежутки времени в жидкости могут формироваться небольшие области с координационными числами 11, 12 и даже 13, что превышает координационное число у наиболее плотноупакованных кубических гранецентрированных кристаллов (12). Но такие области не являются устойчивыми.
Промежуточное положение между твердыми кристаллическими телами (с правильными трехмерными кристаллическими решетками) и жидкими расплавами (с ближним порядком в расположении атомов) занимают жидкие кристаллы. Такое название получили некоторые органические вещества, состоящие из удлиненных (одномерных) или плоских (двумерных) молекул. При плавлении этих веществ молекулы, взаимодействуя между собой, выстраиваются в определенном порядке.
Упорядоченное состояние сохраняется в определенном интервале температур от точки плавления до точки перехода в изотропную жидкость, с расположением молекул характерным для изотропных жидкостей. Упорядоченное расположение молекул может быть в одном направлении, либо в двух направлениях, но не в трех направлениях, как в твердом кристалле.
Наличие упорядоченного расположения молекул в жидких кристаллах обусловливает анизотропию их свойств (удельного электросопротивления, диэлектрической проницаемости, оптических и других характеристик).
Как и в случае твердых кристаллов, эффект анизотропии свойств используют для технических приложений в приборостроении (LCD -мониторы), часовой и медицинской промышленности и других отраслях народного хозяйства.
Рассмотрим теперь с чем же связано существование металлов при одних температурах в твердом состоянии, а других - в жидком и каковы условия перехода от одного состояния к другому.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с меньшей свободной энергией или термодинамическим потенциалом F, т. е. когда свободная энергия кристалла меньше свободной энергии жидкой фазы.
Свободной энергией (термодинамическим потенциалом) называют ту составляющую полной энергии вещества, которая обратимо изменяет свою величину при изменении температуры. С повышением температуры величина свободной энергии уменьшается.
Если превращение происходит с небольшим изменением объема, то
F = H - TS, (6)
где H - полная энергия системы;
Т - абсолютная температура;
S - энтропия.
Изменение свободной энергии жидкого и твердого состояний в зависимости от температуры показано на рис. 10. Выше температуры Тпл более устойчив жидкий металл, имеющий меньший запас свободной энергии, а ниже этой температуры устойчив твердый металл. При температуре Тпл величины свободных энергий жидкого и твердого состояний равны. Температура Тпл соответствует равновесной температуре кристаллизации (или плавления) данного вещества, при которой обе фазы (жидкая и твердая) могут сосуществовать одновременно и притом бесконечно долго.
Процесс кристаллизации при этой температуре еще не начинается. Процесс кристаллизации развивается, если созданы условия, когда возникает разность свободных энергий, образующаяся вследствие меньшей свободной энергии твердого металла по сравнению с жидким.
Следовательно, процесс кристаллизации может протекать только при переохлаждении металла ниже равновесной температуры Тпл. Разность между температурами Тпл и Тк, при которых может протекать процесс кристаллизации, называется - степень переохлаждения: DТ = Тпл - Тк (рис. 10), а разность свободных энергий жидкой фазы и кристалла DF возникающая при переохлаждении расплава – термодинамический стимул кристаллизации DF = Fж – FТ.
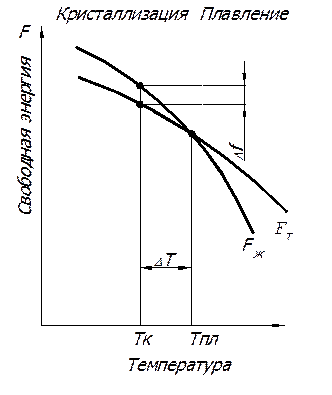
Рис. 10. Изменение свободной энергии металла в жидком (Fж)
и твердом (FТ) состояниях в зависимости от температуры

Рис. 11. Кривые охлаждения при кристаллизации металла
Термические кривые, характеризующие процесс кристаллизации чистых металлов при охлаждении с различными скоростями, даны на рис. 11. При очень медленном охлаждении степень переохлаждения невелика и процесс кристаллизации протекает при температуре, близкой к равновесной (рис. 11, кривая v1). На термической кривой при температуре кристаллизации отмечается горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации, несмотря на отвод тепла при охлаждении.
С увеличением скорости охлаждения степень переохлаждения возрастает (кривые v2, v3) и процесс кристаллизации протекает при температурах, лежащих ниже равновесной температуры кристаллизации. Степень переохлаждения зависит от природы и чистоты металла. Чем чище жидкий металл, тем более он склонен к переохлаждению. Однако следует заметить, что относительно легко значительные переохлаждения могут быть достигнуты только при кристаллизации органических веществ. Металлы же переохлаждаются в заметной степени лишь при очень больших скоростях охлаждения (порядка 105 – 106 К/с).
При таких скоростях охлаждения кристаллические зародыши не образуются, и металл затвердевает в аморфном состоянии. При обычных же скоростях охлаждения, используемых в технике (порядка десятков градусов в секунду) переохлаждение может составлять всего десятые, а иногда и сотые доли градуса.
Еще Д. К. Чернов (1868 г.) впервые отметил, что в процессе кристаллизации следует различать две стадии:
1) образование зародышей кристаллов;
2) рост этих зародышей.
Тамман ввел количественные параметры для описания этих стадий, а именно:
1) число зародышей, образующихся в единице объема за единицу времени;
2) линейную скорость роста этих зародышей, измеряемую в единицах длины, деленной на время.
Под линейной скоростью роста кристаллов понимают скорость перемещения поверхности кристалла в направлении перпендикулярном этой поверхности. Максимальная величина этой скорости составляет несколько миллиметров в секунду.
По представлениям Таммана устойчивыми могут быть зародыши кристаллической фазы сколь угодно малого размера. Однако, как показал Гиббс, при рассмотрении равновесия необходимо учитывать энергию поверхности раздела жидкой и кристаллической фаз. Кристаллы становятся устойчивыми лишь после достижения определенных размеров, называемых критическими. Рост же зародышей до критических размеров, из-за увеличения поверхности их раздела с жидкостью, приводит не к уменьшению, а к увеличению свободной энергии.
Как показали многочисленные экспериментальные исследования, и число зародышей и линейная скорость роста определяются, в первую очередь, величиной переохлаждения. При снижении температуры ниже температуры плавления оба указанных параметра сначала растут (см. рис. 12), а затем, достигнув максимума, начинают снижаться.
При анализе изображенных на рисунке кривых следует обратить внимание на два момента:
1) форма кривой, описывающей изменение числа зародышей с ростом переохлаждения (кривая 1), несколько отличается от кривой, описывающей скорость линейного роста (кривая 2): на кривой 1 отчетливо выражен максимум при определенной величине переохлаждения, на кривой 2 максимальные значения скорости соответствуют довольно широкому интервалу переохлаждении (горизонтальный участок на кривой);

Рис. 12. Кривые Таммана – влияние степени переохлаждения DТ на
скорость зарождения центров (зародышей) кристаллизации vз и
линейную скорость роста кристаллов vл
2) максимумы на кривых 1 и 2 обычно наблюдаются при различных DТ. Если температура, соответствующая максимуму на кривой числа зародышей (кривая 1), совпадает с температурой максимальной скорости роста (кривая 2), то сильно переохладить жидкость невозможно; если же максимум на кривой 1 находится при больших DТ чем на кривой 2, то кристаллизация жидкости может происходить при значительных переохлаждениях.
Первая стадия процесса кристаллизации - образование зародышей. При образовании зародыша новой фазы, например, кристалла радиусом r, свободная энергия твердого тела, т. е. закристаллизованного объема меньше свободной энергии того же количества жидкости на величину
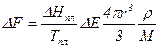 (7)
(7)
где М - молекулярный вес вещества зародыша;
r - плотность кристалла.
Повышение свободной энергии частицы с поверхностью 4pr2 при увеличении ее радиуса от r до r + dr, равно 8prsdr, где s - энергия единицы поверхности раздела фаз, равная работе, затрачиваемой на ее создание. Суммарное изменение свободной энергии, обусловленное образованием кристалла с учетом поверхностной энергии равно:
DF = 4/3(pr3r)(FТ – Fж)/M + 4pr2s. (8)
Это суммарное изменение свободной энергии будет изменяться с размером зародыша по кривой 3, представленной на рис. 13 и являющейся суммой кривых 1 и 2.
Критический размер зародыша определяется соотношением:
rкр = 2sТплМ/QкрDТr, (9)
где Qкр - теплота плавления, равная - DН.
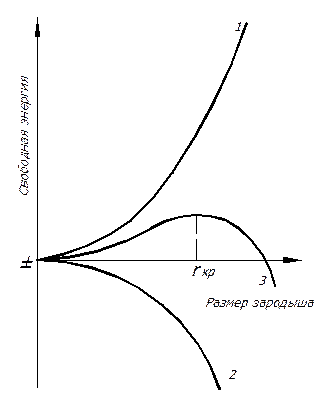
Рис. 13. Изменение свободной энергии – поверхностной (1), объемной (2)
и суммарной (3) в зависимости от размера зародыша
Зародыши новой фазы, имеющие критические размеры, называются «равновесными»: они могут, сохранятся в неизменном состоянии при длительном соприкосновении с окружающей жидкостью. Но если размер критического зародыша немного уменьшится, то он будет уменьшаться вплоть до полного растворения; если же он немного увеличится, то зародыш начнет самопроизвольно расти.
Таким образом, чем выше переохлаждение (DТ = Тпл - Тмет), тем меньше критический диаметр зародыша, начиная с которого дальнейший рост зародыша происходит с уменьшением свободной энергии, а сам процесс образования зародыша будет происходить с повышением свободной энергии и будет хотя и самопроизвольным, но мало вероятным. Он осуществляется лишь благодаря флуктуациям (случайным колебаниям) состава.
Число зародышей, образующихся при кристаллизации, в единице объема в единицу времени, пропорционально произведению вероятности образования зародыша на вероятность того, что зародыши эти дорастут до критических размеров.
При превышении же критических размеров дальнейший рост зародыша происходит с уменьшением свободной энергии. Аналогично изменение линейной скорости роста зародышей с DТ.
Таким образом, критический размер зародышей, т.е. кристаллов, находящихся в равновесии с расплавом, зависит и от величины переохлаждения и от поверхностной энергии (поверхностного натяжения).
Размеры, при которых начинает осуществляться самопроизвольный рост зародышей, для большинства металлов составляют примерно 10 атомных диаметров, при переохлаждении примерно равном 0,01 0С. Скорость образования зародышей проходит через максимум: вблизи от температуры плавления она мала из-за большой величины rкр (DТ малы). С понижением температуры (увеличением степени переохлаждения) скорость зарождения возрастает, потому что уменьшается rкр (несмотря на небольшое снижение энергии теплового движения атомов), а затем скорость снова начинает уменьшаться, потому, что тепловое движение атомов становится столь слабым, что практически останавливается рост «подзародышей» до зародышей критического размера.
Вторая стадия процесса кристаллизации - рост кристаллов. Самопроизвольный рост трехмерных зародышей происходит как путем присоединения к нему отдельных атомов (или молекул), так и путем образования на его гранях двухмерных зародышей, т.е. плоских частиц новой фазы. При любом механизме роста вероятность присоединения должна быть пропорциональна величине поверхности граней зародыша. При этом не все грани кристалла будут расти с одинаковой скоростью, так как их поверхностная энергия различна вследствие различий плотности упаковки атомов (в кубических кристаллах поверхностная энергия граней (100) немного меньше, чем всех остальных). Практически реализуются различные схемы роста кристаллов. Экспериментально показано, что рост двумерных зародышей на гранях кристаллов приводит сначала к образованию ступенек, а затем к спиралевидному росту.
Рассмотренный выше механизм роста кристаллов основан на представлениях об идеальном кристалле. Однако в последнее время было показано, что решающее значение для роста кристаллов имеет наличие дефектов. А именно, наличие винтовых дислокаций снижает межфазную энергию, что и облегчает процесс роста зародышей. Если винтовая дислокация выходит на поверхность образующего зародыша, то на его поверхности возникает ступенька высотой, равной межатомному расстоянию. В этом случае захват атомов из жидкости облегчается, следовательно, возрастает и скорость роста зародыша. Наличие винтовых дислокаций приводит к спиралевидному росту кристаллов. Для многих кристаллов, в т.ч. и металлических, спиралевидный механизм роста подтвержден экспериментально.
Кривая зависимости скорости роста от переохлаждения была приведена на рис. 12. Однако следует отметить, что получение вполне достоверных кривых этой зависимости от величины переохлаждения - задача, которая до сих пор не решена.
Дело в том, что при больших скоростях роста, выделяющаяся скрытая теплота кристаллизации существенно повышает температуру расплава вблизи грани растущего кристалла. Но точных методов измерения температуры вблизи грани растущего кристалла нет. Поэтому экспериментально определить вид кривых Vл = f(DT) с достоверной точностью пока невозможно. Поэтому утверждать, что они имеют выраженный максимум или характеризуются некоторым плато пока нельзя.
Но все же на основании имеющихся экспериментальных данных и теоретического анализа можно отметить, что линейная скорость кристаллизации начинает уменьшаться при меньших переохлаждениях, чем скорость образования кристаллов.
Для металлов же вообще кристаллизация заканчивается раньше, чем будут достигнуты величины переохлаждения, при которых начинает уменьшаться число зародышей кристаллизации и скорость роста, т.е. существуют только восходящие ветви кривых.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1417; Нарушение авторских прав?; Мы поможем в написании вашей работы!