
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титровании
|
|
|
|
Графические способы определения точки эквивалентности при
Метод потенциометрического анализа
Потенциометрический анализ может быть выполнен как прямым, так и косвенным методом (метод потенциометрического титрования). В прямом методе измеряют реальный потенциал раствора, а затем по уравнению Нернста рассчитывают концентрацию раствора. При косвенном методе проводят потенциометрическое титрование определяемого вещества подходящим титрантом. При этом можно проводить как прямое, так и обратное титрование. По кривым титрования определяют объём титранта, затраченного на титрование, который подставляют в расчётные формулы, используемые в титриметрических методах анализа. Потенциометрическоетитрование благодаря своим широким возможностям используется чаще.
Результаты измерений методом потенциометрического титрования более точны, чем при использовании метода прямой потенциометрии, так как в этом случае вблизи точки эквивалентности небольшому изменению концентрации соответствует большое изменение потенциала индикаторного электрода. В ходе титрования измеряют и записывают значение потенциала ячейки после добавления каждой порции титранта.
Потенциометрическое титрование можно проводить, используя реакции нейтрализации, окисления-восстановления, осаждения или комплексообразования. В методе кислотно-основного титрования подбирают индикаторный электрод, потенциал которого зависит от рН раствора. Таких электродов несколько: водородный, хингидронный, сурьмяный, однако наиболее широкое применение нашёл стеклянный электрод. При осадительном титровании в качестве индикаторного электрода используют металл, составляющий электродную пару с определяемым ионами. Например, при титровании серебра растворами галогенидов можно использовать в качестве индикаторного электрода серебряный электрод. При комплексонометрическом титровании индикаторным электродом может служить либо металлический электрод, обратимый к определяемым ионам металла, либо платиновый электрод, если в растворе присутствует окислительно-восстановительная пара: Fe3+/ Fe2+, Cu2+/ Cu+, Co3+/Co2+.
При окислительно-восстановительном титровании в качестве индикаторного электрода чаще всего используют платиновый электрод.
Для определения конечной точки потенциометрического титрования (точки эквивалентности) можно использовать различные способы. Наиболее простой способ — построение кривой титрования: графика зависимости потенциала электрода от объема титранта (рисунок 3, а). Для большей точности определения точки эквивалентности применяют дифференциальные кривые титрования (рисунок 15, б), которые строят по вычисленным значениям  или
или 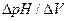 . Величины
. Величины  или
или 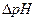 определяют как разность между показаниями прибора после добавления каждой порции титранта
определяют как разность между показаниями прибора после добавления каждой порции титранта 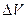 .Наибольшее значение
.Наибольшее значение 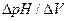 приобретает в точке эквивалентности. Дифференциальный способ построения кривых титрования позволяет достаточно четко (в пределах 0,05…0,1 см3) выделить точку эквивалентности. Эту особенность дифференциальных кривых можно применить при титровании слабых кислот и оснований и их смесей.
приобретает в точке эквивалентности. Дифференциальный способ построения кривых титрования позволяет достаточно четко (в пределах 0,05…0,1 см3) выделить точку эквивалентности. Эту особенность дифференциальных кривых можно применить при титровании слабых кислот и оснований и их смесей.
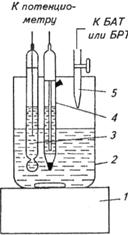
1-магнитная мешалка; 2-ячейка для анализируемого раствора;
3-индикаторный электрод; 4 - насыщенный хлорсеребряный электрод

В простейшем случае для потенциометрического титрования собирают установку, состоящую из стакана, магнитной мешалки, рабочего электрода, электрода сравнения, бюретки и потенциометра (рис.14). Электрод сравнения соединяют с титруемым раствором через электролитический мост. В стакан отмеривают определенный объем титруемого раствора и порциями добавляют титрант. Предварительно проводят пробное титрование для ориентировочного определения точки эквивалентности. После добавления каждого кубического метра титранта записывают показания прибора либо в единицах рН, либо в милливольтах (мВ). Возле точки эквивалентности для большей точности титрант
добавляют по каплям. После точки эквивалентности титрование продолжают, добавляя еще некоторый о6ъем титранта. По полученным данным строят кривую потенциометрического титрования.
Кривая потенциометрического титрования имеет вид, аналогичный кривой титрования в титриметрическом анализе (рисунок 15, а). По кривой титрования определяют точку эквивалентности, которая находится в середине скачка титрования. Для этого проводят касательные к участкам кривой титрования и по середине касательной скачка титрования определяют точку эквивалентности; Для большей точности определения точки эквивалентности применяют дифференциальные кривые титрования (рисунок 15, б), которые строят по вычисленным значениям  или
или 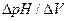 . Величины
. Величины  или
или 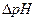 определяют как разность между показаниями прибора после добавления каждой порции титранта
определяют как разность между показаниями прибора после добавления каждой порции титранта 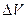 .Наибольшее значение
.Наибольшее значение 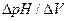 приобретает в точке эквивалентности. Дифференциальный способ построения кривых титрования позволяет достаточно четко (в пределах 0,05…0,1 см3) выделить точку эквивалентности. Эту особенность дифференциальных кривых можно применить при титровании слабых кислот и оснований и их смесей.
приобретает в точке эквивалентности. Дифференциальный способ построения кривых титрования позволяет достаточно четко (в пределах 0,05…0,1 см3) выделить точку эквивалентности. Эту особенность дифференциальных кривых можно применить при титровании слабых кислот и оснований и их смесей.

Рисунок – Кривые потенциометрического титрования
Метрологические характеристики метода потенциометрии таковы: чувствительность до 10-5 моль/дм3; точность прямых методов 2…10%, косвенных – 0,5…1%, воспроизводимость ± 5%.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1205; Нарушение авторских прав?; Мы поможем в написании вашей работы!