
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Флюориметрия
|
|
|
|
Многие органические и неорганические вещества способны к самостоятельному свечению, возникающему под различными воздействиями. Это явление получило название люминесценции. По характеру процессов, вызывающих люминесценцию, различают: 1) фотолюминесценцию (возбуждение видимым или ультрафиолетовым светом); 2) хемилюминесценцию (возбуждение за счет энергии химических реакций); 3) катодолюминесценцию (возбуждение электронным ударом); 4) термолюминесценцию (возбуждение нагреванием); 5) триболюминесценцию (возбуждением механическим воздействием). В химическом анализе имеют значение первые два вида люминесценции.
Люминесценцию также классифицируют по наличию послесвечения. Она может прекращаться сразу при исчезновении возбуждения – флюоресценция или продолжаться определенное время после прекращения возбуждающего воздействия – фосфоресценция. В химическом анализе в основном используют явление флюоресценции, поэтому метод назван флюориметрией. В разработку теории люминесценции большой вклад внес советский ученый С. И. Вавилов.
Люминесценция возникает как следствие поглощения веществом квантов 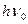 электромагнитного излучения и возбуждения его молекул или атомов. Перейдя в возбужденное состояние В, молекула или атом вещества через некоторое время (
электромагнитного излучения и возбуждения его молекул или атомов. Перейдя в возбужденное состояние В, молекула или атом вещества через некоторое время (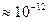 с) возвращается в основное состояние А, излучив избыточную энергию в виде квантов. При этом часть энергии излучается сначала в виде кванта теплового излучения
с) возвращается в основное состояние А, излучив избыточную энергию в виде квантов. При этом часть энергии излучается сначала в виде кванта теплового излучения 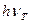 , что приводит к определенной стабилизации молекулы на нижнем возбужденном уровне Г, затем происходит излучение кванта
, что приводит к определенной стабилизации молекулы на нижнем возбужденном уровне Г, затем происходит излучение кванта 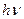 В- или УФ-области спектра, сопровождающееся переходом в основное состояние (рисунок 10). В связи с этим энергия (частота) флюоресцентного излучения меньше энергии (частоты) возбуждающего излучения (за счет теплового излучения). Это явление названо законом Стокса по имени ученого, открывшего его. Способностью к флюоресценции обладают некоторые ионы металлов (уран), многие комплексы и органические (в основном ароматические) соединения.
В- или УФ-области спектра, сопровождающееся переходом в основное состояние (рисунок 10). В связи с этим энергия (частота) флюоресцентного излучения меньше энергии (частоты) возбуждающего излучения (за счет теплового излучения). Это явление названо законом Стокса по имени ученого, открывшего его. Способностью к флюоресценции обладают некоторые ионы металлов (уран), многие комплексы и органические (в основном ароматические) соединения.
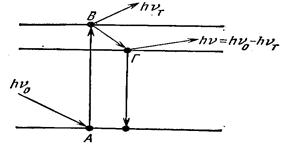
Рисунок 4 – Механизм возникновения флюоресценции
Спектры флюоресценции и поглощения вещества связаны между собой определенными закономерностями. Первая из них заключается в том, что центр тяжести спектра флюоресценции по закону Стокса лежит в более длинноволновой области, чем центр тяжести спектра поглощения, т.е. 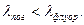 Вторая закономерность – правило зеркальной симметрии, в соответствии с которым спектры поглощения и флюоресценции, построенные в шкале частот, приближенно симметричны относительно прямой, проходящей через точку их пересечения.
Вторая закономерность – правило зеркальной симметрии, в соответствии с которым спектры поглощения и флюоресценции, построенные в шкале частот, приближенно симметричны относительно прямой, проходящей через точку их пересечения.
В аналитической химии имеют дело преимущественно с растворами флюоресцирующих веществ. Интенсивность флюоресценции зависит от концентрации вещества и связана с квантовым и энергетическим выходами, длиной волны возбуждающей радиации, температурой раствора, присутствием в растворе посторонних веществ, величиной рН раствора, природой растворителя. При изменении этих факторов может происходить как усиление флюоресценции, так и ее ослабление или гашение. Последнее происходит вследствие того, что излучаемая энергия передается молекулам других веществ, находящимся в растворе, и флюоресценция не возникает. При увеличении температуры происходит так называемое температурное гашение. При высоких концентрациях возникает явление концентрационного гашения флюоресценции. Присутствие в растворе посторонних примесей также может привести к гашению. Для большинства флюоресцирующих веществ характерен свой интервал значений рН раствора, при которых возникает флюоресценция.
Флюоресцентные методы анализа делятся на прямые и косвенные. К прямым методам относятся такие, в которых непосредственно измеряется интенсивность флюоресценции. В косвенном флюоресцентном анализе флюоресценция служит индикатором, указывающим окончание процесса определения вещества. Методы прямого флюоресцентного анализа основаны на законе С. И. Вавилова, согласно которому в области малых концентраций (10-7 – 10-4 моль/дм3) интенсивность флюоресценции Ф раствора линейно зависит от концентрации: Ф = КС. При увеличении концентрации раствора линейность нарушается вследствие гашения флюоресценции или уменьшения ее интенсивности. Здесь аналитические определения сопряжены с большой погрешностью и, как правило, не проводятся.
Прямыми флюоресцентными методами количественно могут определяться в растворе вещества, обладающие собственной флюоресценцией (определение витамина В1; образующие с различными реагентами флюоресцирующие соединения (определение Al3+ по его комплексу с салицилаль-о-аминофенолом); гасящие флюоресценцию различных реагентов, связывая их в нефлюоресцирующие соединения (определение Zn2+ по гашению флюоресценции родамин (С) – тиоцианата, который связывается с цинк-ионами).
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1250; Нарушение авторских прав?; Мы поможем в написании вашей работы!