
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы теории сплавов. Диаграммы состояния двойных систем
|
|
|
|
4.1. Строение сплавов:
Чистые металлы обладают низкой прочностью и не обеспечивают требуемых механических и технологических свойств, поэтому наиболее широко в технике (промышленности) используют сплавы.
Металлическим сплавом называется вещество, полученное сплавлением двух и более исходных веществ, преимущественно металлических, и обладающее металлическими свойствами.
В настоящее время сплавы получают:
- сплавлением;
- спеканием (порошковая металлургия);
- электролизом;
- возгонкой (сублимацией);
- плазменным напылением и др.
Вещества, образующие сплав, называются компонентами.
В сплавах компоненты могут различно взаимодействовать друг с другом, образуя те или иные фазы.
Фазой называется однородная по химическому составу, кристаллической структуре, физическим свойствам часть гетерогенной термодинамической системы, отделенная от других ее частей поверхностью раздела, при переходе через которую химический состав или структура изменяются скачком.
Система – это совокупность фаз, находящихся в равновесии и разграниченных поверхностями раздела.
При кристаллизации сплавов могут образовываться следующие основные твердые фазы: твердые растворы, химические соединения, механические смеси.
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого или других компонентов располагаются в кристаллической решетке первого компонента (растворителя), изменяя ее размеры (периоды).
Твердые растворы имеют металлический тип связей. По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы: замещения, внедрения, вычитания (рис. 5.1).
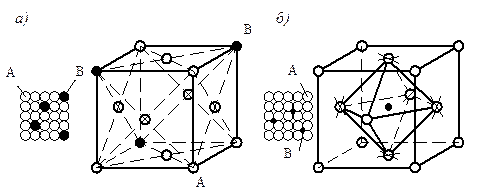
Рис. 4.1. Схема строения кристаллических решеток: а – твердый раствор замещения; б – твердый раствор внедрения.
Твердые растворы замещения образуются при замене атомов в кристаллической решетке растворителя атомами растворенного компонента (рис. 5.1а). Твердые растворы замещения могут быть с ограниченной и
неограниченной растворимостью и могут быть образованы при соблюдении следующих условий:
- компоненты должны обладать одинаковыми по типу кристаллическими решетками;
- различие в атомных радиусах компонентов не должно быть больше 8-13 % (при разности атомных радиусов меньше 8 % происходит полная взаимная растворимость одного компонента в другом и образуется неограниченный твердый раствор; при разности атомных радиусов в пределах 8-13 % получаются растворы ограниченной растворимости одного компонента в другом; при разности атомных радиусов больше 15 % имеет место полная взаимная нерастворимость и образование механической смеси или химического соединения);
- компоненты должны принадлежать к одной и той же группе периодической системы элементов или к смежной, обладать близким строением валентной оболочки атомов (чем больше разница в валентности элементов, вступающих во взаимодействие, тем меньше растворимость).
Например: В одновалентной меди (Cu), имеющей гранецентрированную кубическую решетку (ГЦК) растворяется 38 % Zn (2-валентного), 9 % Al (3 – валентного), 6 % As (5 – валентного). В системе Au – Ag существует полная взаимная растворимость.
Твердые растворы внедрения (рис.5.1б)образуются только в том случае, если внедряемые атомы имеют малые размеры и проникают в поры кристаллической решетки растворителя (H, C, N, B).
Твердые растворы вычитания образуются на базе металлических соединений (интерметаллидов), в структуре которых имеются узлы кристаллической решетки, не занятые атомами одного из компонентов.
Твердые растворы обозначаются малыми буквами греческого алфавита (рис.4.2)

Рис. 4.2. Схема структуры твердого раствора (компонента В в А)
При определенных условиях атомы растворенного элемента могут занимать определенные места в решетке, т.е. упорядоченно располагаться. Такие твердые растворы называются упорядоченными твердыми растворами (рис.4.3).

Рис. 4.3. Кристаллические решетки упорядоченных твердых растворов в системе Cu – Au
При упорядочении решетки (диффузионный отжиг) изменяется период решетки, но тип решетки остается. Например, упорядоченный раствор CuAu (1:1) имеет гранецентрированную тетрагональную решетку с отношением периодов с / а = 0,935, а неупорядоченный раствор – кубическую гранецентрированную с отношением периодов с / а = 1.
Твердые растворы составляют основу большинства промышленных конструкционных и инструментальных сплавов и обладают хорошей технологической пластичностью.
4.2. Химические соединения:
Характерными особенностями химических соединений являются:
- кристаллическая решетка отличается от решеток компонентов, образующих соединение (рис.5.4). Атомы в решетке химического соединения располагаются упорядоченно, т.е. атомы каждого компонента расположены закономерно и по определенным узлам решетки. Большинство химических соединений имеют сложную кристаллическую структуру;
- в соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой АnBm, где А и В – соответствующие элементы; n и m – простые числа. Например, у CuAl2 соотношение количества атомов Cu и Al – 1: 2;
- свойства соединения резко отличаются от свойств образующих его компонентов;
- температура плавления (диссоциации) постоянная;
- образование химического соединения сопровождается значительным тепловым эффектом.
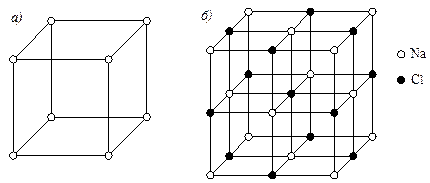
Рис. 5.4. Кристаллические решетки: а - Na; б – химического соединения NaCl
Химические соединения делятся на две группы:
- соединения с нормальной валентностью, т.е. соединения металлов с типичными неметаллами. Такими соединениями являются оксиды, сульфиды, хлориды. В сплавах эти соединения присутствуют в виде так называемых неметаллических включений;
- металлические соединения, которые отличаются разнообразием типов межатомных связей (металлической, ковалентной, ионной) и благодаря этому характеризуются металлическим блеском, электропроводностью и в отдельных случаях сверхпроводимостью. Металлические соединения при обычных температурах тверды и хрупки, однако при нагреве до температур, равных 70…90 % от температуры плавления, эти соединения очень пластичны, что объясняется увеличением при нагреве доли металлической связи между атомами.
При промежуточных значениях разности атомных размеров также возможно образование химических соединений. К ним относятся:
- Фазы Лавеса (устойчивое химическое соединение с ионным типом связи), образующееся между элементами различной природы, атомные диаметры которых находятся приблизительно в соотношении 1: 1,2. Эти фазы удовлетворяют условиям, характеризующим химическое соединение с соотношением атомов, которое укладывается в формулу АВ2. Например: MgZn2, MgNi2..
Фазы Лавеса встречаются как упрочняющие интерметаллидные фазы в жаропрочных сплавах.
- Фазы внедрения, которые образуют металлы переходных групп с металлоидами, имеющими малый атомный радиус. Фазы внедрения образуются, если отношение атомного радиуса металлоида к атомному радиусу металла равно или меньше 0,59. В отличие от фаз Лавеса, при образовании фаз внедрения металлы образуют простые кристаллические решетки (обычно ОЦК, ГЦК, ГПУ). В этом случае образуются химические соединения, которые имеют соотношение атомов, укладывающиеся в простые формулы. Например:
Ме4Х: Fe4N, Mn4N;
Ме2Х: W2C, Mo2C, Fe2N;
МеХ: WC, VC, TiC, NbC, TiN.
Карбиды и нитриды, встречающиеся в сталях, являются фазами внедрения.
4.3. Электронные соединения (фазы Юм – Розари):
Этот вид соединений образуется между двумя металлами группы: Cu, Ag, Au, Fe, Co, Ni, Pt, Pd c металлами группы Be, Zn, Cd, Al, Sn, Si. Соединения этого типа имеют определенное отношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Каждому соотношению числа валентных электронов и числу атомов соответствует определенный тип кристаллической решетки: при соотношении 3: 2 (1,5) образуется ОЦК-решетка (b - фаза). Например, химические соединения Cu-Zn, Cu-Be, Cu5Sn, NiAl; при соотношении 21: 13 (1,62) образуется сложная кубическая решетка (g - фаза). Например, химические соединения Cu5Zn8, Cu3Cd8, Cu81Sn8; при соотношении 7: 4 (1,75) образуется гексагональная решетка (e - фаза). Например, химические соединения CuZn3, CuCd3, Cu3Si, Cu3Sn.
При сплавлении переходных металлов, имеющих близкие размеры атомов, образуются фазы переменного состава (s - фаза). Эти фазы имеют частично упорядоченную сложную решетку.
В железных сплавах, содержащих больше 20 % Cr, которые используются как коррозионно-стойкие конструкционные материалы, очень медленное охлаждение из области твердого раствора или изотермические выдержки при 800-600 оС приводят к образованию кристаллов s - фазы, которое сопровождается резким увеличением твердости и охрупчиванием сплавов.
4.4. Механические смеси:
Механические смеси образуются при сплавлении компонентов с большим различием атомных радиусов, значительным различием электромеханических свойств, когда их взаимная растворимость очень мала и они не вступают в химическую реакцию с образованием химического соединения. При этих условиях сплав будет состоять из кристаллов (рис. 5.5) исходных компонентов (например: сплавы Pb-Sb, Zn-Sn, Pb-Bi и др.).
Механическая смесь может быть образована:
- в результате кристаллизации, когда из жидкости одновременно кристаллизуются компоненты А и В (эвтектика – ж ® А + В)
- в результате кристаллизации, когда из жидкости одновременно кристаллизуются твердые растворы a и b (эвтектика – ж ® a + b);
- в результате распада твердого раствора на две твердые фазы (эвтектоид – g®a + А nBm).
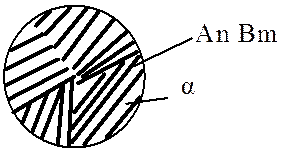
Рис. 5.5. Условное обозначение механических смесей
4.5. ДИАГРАММА СОСТОЯНИЯ:
Диаграмма состояния – это графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов в условиях равновесия.
Между тем, следует помнить, что абсолютное отсутствие взаимной растворимости в реальных сплавах не встречается. Компоненты в сплаве обозначают символами их элементов.
Диаграмма состояния позволяет:
- определить для каждого сплава, какие фазы, при каких температурах находятся в равновесии;
- установить состав и количественное соотношение находящихся в равновесии фаз;
- предсказать приблизительно структуру сплава, а иногда определить количественное соотношение структурных составляющих.
Общие закономерности сосуществования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз или законом Гибса.
Правило фаз (или закон Гибса) дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов:
C = K – F + 2,
где (если считать для металлов давление постоянным, т.е. Р - const)
C – число степеней свободы, т.е число внешних (температура и давление) и внутренних (концентрация) факторов, которые можно изменить без изменения числа фаз;
K – число компонентов в системе;
F – число фаз.
Пример: если С = 0, то любое изменение температуры вызывает изменение числа фаз; если С = 1, то возможно изменение температуры без изменения числа фаз.
В жидком состоянии:
F = 1 – одна фаза;
К = 1 – один компонент (чистый металл);
С = 1- 1 + 1 = 1 – можно изменять температуру без изменения агрегатного состояния.
В момент кристаллизации:
F = 2 – две фазы (жидкость + кристаллы)
K = 1 – один компонент (чистый металл);
C = 1 – 2 + 1 = 0 – равновесие при строго определенной температуре (Тпл)
Определив степень свободы для чистого металла и сплава в жидком состоянии и в момент кристаллизации, можно построить кривые нагрева в координатах температура – время (рис.6.1, 6.2).
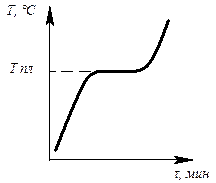

Рис. 6.1. Кривая нагрева Рис. 6.2. Кривая нагрева
чистого металла сплава
Степень свободы для сплава в момент кристаллизации:
F = 2 - две фазы;
K = 2 – два компонента;
С = 2 – 2 + 1.
4.6.1. Построение диаграмм состояния (равновесия)
Для построения диаграмм состояния, особенно для определения температур затвердевания сплава, используется термический анализ. Для изучения превращений в сплаве в твердом состоянии используют методы физико-химического анализа:
- микроанализ;
- рентгеноструктурный;
- дилатометрический;
- электросопротивления;
- акустический.
Последовательность построения диаграмм термическим методом (компоненты А и В, фазы a, L):
- изготавливают несколько сплавов с известной концентрацией (сплав I, II, III, компоненты А и В) (рис. 6.3);
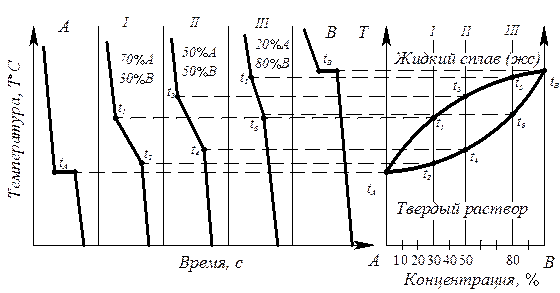
Рис. 6.3. Диаграмма состояния с образованием неограниченных твердых растворов, построенная термическим методом (диаграмма II рода)
- для каждого сплава строят кривые охлаждения в координатах температура – время, по которым определяют температуры начала и конца кристаллизации сплава;
- строят диаграмму состояния в координатах температура – концентрация, где отмечают точки начала и конца кристаллизации, найденные на кривых охлаждения.
Диаграмма состояния получается при соединении критических точек tA, t1, t3, t5, tB, t6, t4, t2, tA плавными кривыми. Полученная кривая tA t1 t3 t5 tB - геометрическое изображение на диаграмме состояния (точка, линия или поверхность) зависимости температур начала кристаллизации (или завершения расплавления) от химического состава сплава. Такая линия называется линия ликвидус. Кривая tA t2 t4 t6 t8 – геометрическое изображение (точка, линия или поверхность) на диагрмме состояния зависимости температуры конца кристаллизации (или начала плавления) от химического состояния сплава Такая линия называется линия солидус.
4.6.2. Правило отрезков или правило рычага
В процессе кристаллизации изменяются концентрация компонента в фазах и количество фаз. Для их определения служит правило фаз.
Рассмотрим процесс кристаллизации произвольного сплава (рис.6.4) состава 50 % А и 50 % В при очень медленном охлаждении (когда успевают проходить диффузионные процессы).
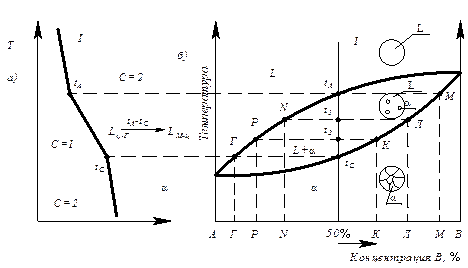
Рис. 6.4. Кривая охлаждения сплава (а) и диаграмма состояния сплава с неограниченной растворимостью в твердом состоянии (б)
При температуре tA начинается кристаллизация.
В процессе кристаллизации в интервале температур tА и tс в жидкой фазе выделяются кристаллы a(альфа) твердого раствора различного состава.
За счет диффузионных процессов (при медленном охлаждении) состав жидкой фазы изменяется по кривой линии tА ® N ® P ® Г (линия ликвидус) (рис.6.4). Состав кристаллов изменяется по линии солидус М®Л®К® tc (aM – tс) (рис.6.4).
В момент окончания кристаллизации (точка tС) состав кристаллов такой, как и состав исходной фазы (рис.6.4).
В реальных условиях быстрого охлаждения состав кристаллов будет неоднороден (рис.6.4), так как скорость кристаллизации больше скорости диффузии. Неоднородность химического состава внутри зерна называется дендритной ликвацией.
Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава (рис. 6. 4), проводят горизонтальную линию (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения коноды с линиями диаграммы на ось концентраций показывают составы фаз.
Например, при температуре tA химический состав первичных кристаллов a определяется проекцией точки М на ось концентраций; при температуре t1 состав жидкой фазы определится проекцией точки N на ось концентраций, а состав твердой фазы – проекцией точки Л.
Для того, чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию (коноду). Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Например, при t1 (рис.6.4) количество жидкой фазы определяется отношением отрезков: t1Л / NЛ * 100 %; количество твердой фазы - отношением Nt1 / NЛ * 100 %.
4.6.3. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
Оба компонента А и В в жидком состоянии неограниченно растворимы, а в твердом – совсем не растворимы и не образуют химических соединений (свинец – сурьма) (рис. 6.5). Компоненты А и В взаимодействуют между собой при кристаллизации и образуют механическую смесь.
Механическая смесь двух или более видов кристаллов, одновременно кристаллизующихся из жидкой фазы называется эвтектикой. Это превращение идет при постоянной температуре и степени свободы, равной нулю. Такое превращение называется нонвариантным и может быть выражено схемой:
t - const
Lc ® A + B
Согласно рис. 6.5:
АСВ – линия ликвидус (линия начала кристаллизации);
ДСЕ – солидус (эвтектическая горизонталь), линия конца кристаллизации.
На кривой охлаждения (рис. 6.5) сплава 1:
участок 0 –1 соответствуют охлаждению жидкого сплава;
участок 1 – 2 – выделению кристаллов А;
участок 2 - 2¢ - совместному выделению кристаллов А и В.
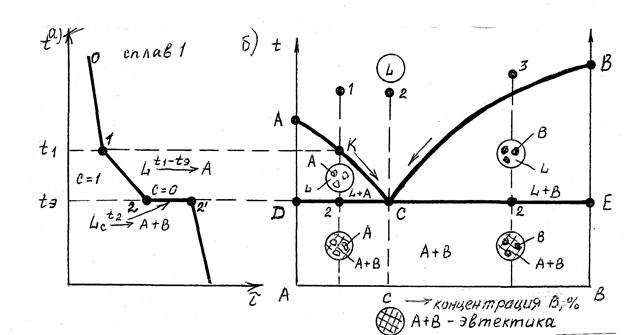
Рис. 6.5. Кривая охлаждения сплавов (а) и диаграмма I рода (б)
Сплавы с концентрацией компонента В до точки С называются дозвтектическими, с концентрацией компонента В больше точки С – заэвтектическими.
4.6.4Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода)
Диаграмма III рода характеризует два компонента А и В, неограниченно растворимых в жидком состоянии, ограниченно – в твердом и не образующих химических соединений (олово – свинец).
При кристаллизации компоненты А и В вступают во взаимодействие и могут образовывать фазы (рис. 6.6):
a - твердый раствор компонента В в А;
b - твердый раствор компонента А в В;
aI, bII – вторичные кристаллы (из твердых кристаллов за счет уменьшения растворимости).
а) б)
|
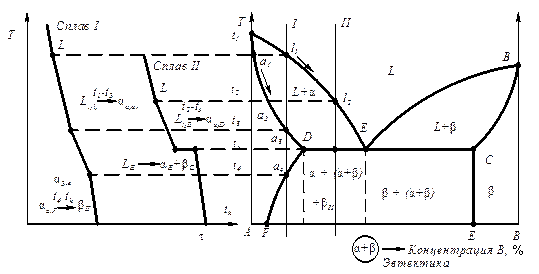
Рис. 6.6. Кривая кристаллизации (а) и диаграмма состояния с эвтектикой (б)
Предельную растворимость компонента В в компоненте А определяет точка D (рис. 6.6). С изменением температуры изменяется растворимость компонента В в А по линии DF, за счет изменения этой растворимости идет выделение вторичных кристаллов bII (рис. 6.7). Точка С определяет предельную растворимость компонентов А в В. В зависимости от температуры растворимость компонента А в В не меняется (линия CE, рис.6.6, б), а поэтому нет вторичных кристаллов aII. Линия DF называется линией сольвиус.
Сольвиус – это графическое изображение (точка, линия, поверхность) на диаграмме состояния зависимости температуры предельной растворимости элементов в твердом состоянии от химического состава.

Рис. 6.7. Схема кристаллизации сплава I

Рис. 6.8. Схема кристаллизации сплава II
Вторичная кристаллизация может происходить из-за изменения растворимости.
Кристаллизация сплава II (рис. 6.7) (доэвтектического) заканчивается образованием эвтектики (рис. 6.8), т. е. три фазы находятся в равновесии, другими словами, происходит нонвариантное превращение (С = 0), и на кривой охлаждения оно отражено горизонтальной площадкой (рис. 6.6 а).
4.6.5. Диаграмма с перитектикой
Другой тип нонвариантного превращения (трехфазного превращения) происходит, когда жидкая фаза взаимодействует с ранее выпавшими кристаллами (b - фазы) и они образуют новый вид кристаллов (a - фазы) (рис.6.9): Lc + bД t const® aР.
|

Рис. 6.9. Диаграмма состояния с перитектикой (а) и кривая
охлаждения сплава I(б)
4.6.6. Диаграмма состояния для сплавов, образующих химическое соединение (IV рода)
Так как компоненты А и В образуют химическое соединение АnBm, то на диаграмме (рис. 6.10) имеем перпендикулярную линию, соответствующую соотношению компонентов в химическом соединении (n: m).
Устойчивое химическое соединение имеет постоянную температуру плавления, поэтому его можно рассматривать как самостоятельный компонент и диаграммы IV рода можно рассматривать как две диаграммы с компонентами A + AnBm и AnBm + B. Вид диаграммы зависит от взаимодействия компонентов А и В между собой и химическим соединением.

Рис. 6.10. Диаграммы состояния с химическим соединением: а – по типу диаграммы I рода; б – по типу диаграммы III рода
4.6.7. Связь диаграммы состояния сплава с его свойствами (самостоятельно)
Вид диаграммы зависит от того, какие фазы образуют оба компонента. Свойства сплава также зависят от того, какие соединения или какие фазы образовали компоненты сплава. Поэтому между видом диаграммы состояния и свойствами сплава существует определенная связь. На рис. 6.12 приведены основные виды диаграмм состояния и соответствующие им закономерности изменения свойств сплава с изменением концентрации. Метод изучения изменений свойств в зависимости от изменения состава и построения диаграммы «состав – свойства» был положен Н.С.Курнаковым в основу разработанного им физико – химического анализа сплавов.
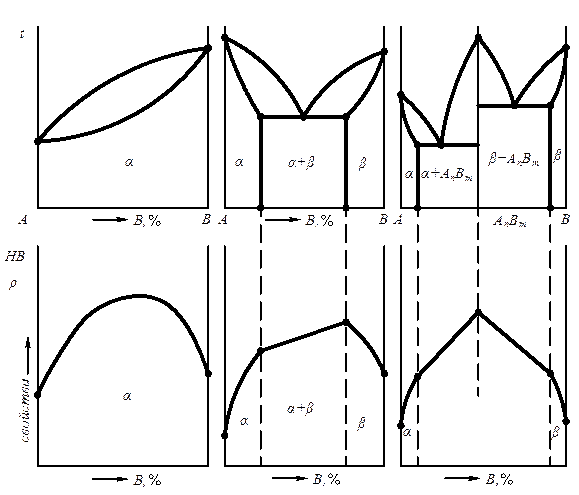
Рис. 6.12. Зависимость между строением сплавов (диаграммой состояния) и их свойствами
По А.А.Бочвару существует связь между типом диаграммы и технологическими свойствами.
Сплавы со структурой твердых растворов пластичны, легко деформируются (прокатываются, куются, прессуются).
Сплавы, имеющие в структуре эвтектическую составляющую, обладают хорошими литейными свойствами (жидкотекучестью, низкой усадкой, концентрированной усадочной раковиной).
5. АНАЛИЗ ДИАГРАММЫ «ЖЕЛЕЗО – ЦЕМЕНТИТ»
Компоненты системы – железо Fe и углерод С (рис. 7.1).
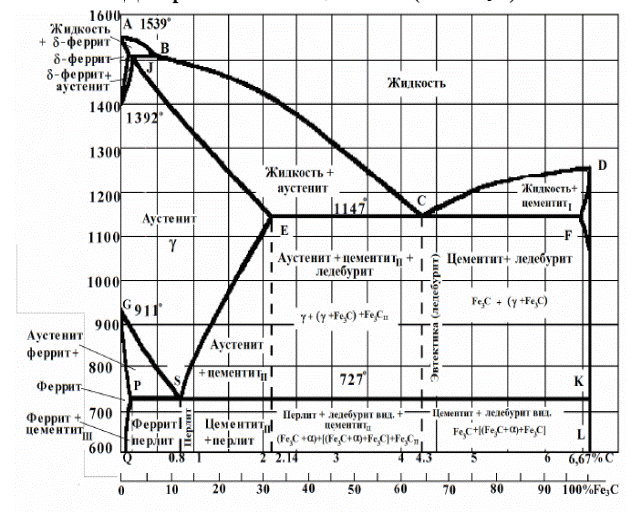
Рис. 7.1. Диаграмма состояния «Железо – карбид железа» (Fe – Fe3C)
Особенности диаграммы определяются полиморфизмом железа и углерода, а также ферромагнетизмом железа:
- от 1539 – 1392 оС железо имеет решетку ОЦК, такая модификация железа называется d (Fe);
- от 1392 – 911 оС железо имеет решетку ГЦК, такая модификация железа называется g(Fe);
- ниже 911 оС железо имеет решетку ОЦК, такая модификация называется a(Fe);
- при температуре 768 оС железо теряет магнитные свойства, и эта температура называется точкой Кюри.
В каждой модификации железа растворяется строго определенное количество углерода с образованием твердых растворов внедрения:
- d - феррит – раствор углерода в d(Fe) с ОЦК решеткой. Максимальная растворимость углерода в d(Fe) составляет 0,1 % при температуре 1499 оС;
- аустенит – твердый раствор углерода в g(Fe) с ГЦК решеткой. Максимальная растворимость углерода в g(Fe) составляет 2,14 % при температуре 1147 оС;
- a - феррит – твердый раствор углерода в a(Fe) с ОЦК решеткой. Максимальная растворимость углерода в a(Fe) составляет 0,025 % при температуре 727 оС.
Кроме указанных выше твердых растворов в системе Fe – С образуются две высокоуглеродистые фазы:
- цементит – химическое соединение Fe3С со сложной орторомбической решеткой, которое содержит 6,67 % углерода и имеет температуру плавления Тпл = 1260 оС. Эта фаза метастабильная, способная к распаду (Fe3С ® 3Fe + Сгр);
- графит – модификация углерода с ГПУ решеткой. Эта фаза стабильная, состоит на 100 % из углерода и имеет температуру плавления Тпл = 3600 оС.
В дополнение к фазам в виде твердых растворов на диаграмме имеются области существования механических смесей:
- перлит – механическая смесь (эвтектоид) феррита и цементита, содержащая 0,8 % С (рис. 7.1, точка S);
- ледебурит – механическая смесь (эвтектика) аустенита и цементита в интервале температур 1147 – 727 оС или перлита и цементита при температурах ниже 727 оС, содержащая 4,3 % углерода (рис. 7.1, точка С).
Сплошными линиями изображена диаграмма Fe – Fe3C, штриховыми – диаграмма Fe – С (рис.7.1). Основной является диаграмма Fe – Fe3С. Однофазные области диаграммы:
- выше линии ABCD (линия ликвидус) – жидкость (L);
- область AHN – область d - феррита;
- область NJESG – область аустенита;
- область GPQ – область a - феррита;
- линия LD или KD – область цементита Fe3C.
Остальные области диаграммы (рис. 7.1) – двухфазные: ледебурит, перлит и их комбинации.
5.1. Характеристика линий и точек диаграммы Fe – Fe3C
Линия АВСD - линия ликвидус – линия начала кристаллизации сплава и состоит она из трех частей:
- AB – начало образования d- феррита;
- BC – начало кристаллизации аустенита;
- CD – начало кристаллизации цементита Fe3C.
Линия AHJECF – линия солидус – линия конца кристаллизации сплава и состоит она из нескольких частей:
- AH – конец кристаллизации d- феррита;
- JE – конец кристаллизации аустенита;
- HJB - линия перитектического превращения:
Жв + FedH 1499 ® FegJ или ЖВ + ФH 1499® A аусJ
- ECF – линия эвтектического превращения:
Жс 1147® gЕ + Fe3CF или Жс 1147® АЕ + ЦI
Остальные линии соответствуют превращениям в твердом состоянии:
- NH и NJ (А4) – линии начала и конца полиморфного превращения Fed «Feg;
- GS (А3) и GP – линии начала и конца полиморфного превращения Feg «Fea;
- ES(Аст) – линия выделения вторичного цементита из аустенита (Fe3CII) за счет изменения растворимости углерода в g-железе. Эта линия называется линия сольвиус;
- PQ – линия выделения третичного цементита (Fe3CIII) за счет изменения растворимости углерода в a- железе;
- PSK (А1) – линия эвтектоидного превращения во всех сплавах независимо от содержания углерода:
FegS 727 ® FeaP + Fe3Ck или Ауст ® ФР + ЦII
- KD – линия существования химического соединения Fe3C (цементит);
- MO (А2) – 768 оС - линия магнитного превращения феррита (потеря магнитных свойств железа).
Физический смысл точек диаграммы:
- A – температура плавления и кристаллизации чистого железа;
- B – перитектическая точка;
- C – эвтектическая точка;
- D – температура плавления и кристаллизации цементита;
- N и G - температуры полиморфных превращений чистого железа;
- H – предельная растворимость углерода в d - железе;
- E – предельная растворимость углерода в g - железе;
- S – эвтектоидная точка;
- P и Q – точки предельной растворимости углерода в a - железе;
- M – точка магнитного превращения железа (точка Кюри).
А1, А2, А3, А4 – принятые условные обозначения фазовых превращений.
5.2. Практическое применение диаграммы Fe – Fe3C
Диаграмма Fe – Fe3C позволяет:
- определить температуры фазовых превращений (плавления, кристаллизации, полиморфных превращений, температуры растворимости фаз;
- определить температурные интервалы термической обработки, горячей и холодной обработки металлов давлением.
5.3. Классификация сплавов системы Fe – Fe3C
Сплавы железа с углеродом делятся на две группы:
- стали: сплавы железа с углеродом, содержащие до 2,14 %С, кристаллизация которых заканчивается образованием аустенита, они обладают высокой пластичностью, хорошо деформируются;
- чугуны: сплавы железа с углеродом, содержащие более 2,14 %С и кристаллизация которых заканчивается образованием эвтектики (ледебурита). Чугуны менее пластичны, обладают хорошими литейными свойствами.
5.3.1. Углеродистые стали классифицируются:
- по химическому составу, структуре;
- по способу выплавки;
- по степени раскисления;
- по качеству;
- по назначению.
По химическому составу и микроструктуре стали делятся на три группы:
- доэвтектоидные, которые содержат от 0,02 до 0,8 % углерода и имеют структуру феррит (Ф) или феррито-перлитную (Ф + П) (рис. 7.2а);
- эвтектоидные, которые содержат 0,8 % углерода и имеют структуру 100 % перлита (рис. 7.2б);
- заэвтектоидные, которые содержат от 0,8 до 2,14 % углерода и имеют структуру перлито – цементитную (П + Ц) (рис. 7.2в).
Сплав, содержащий углерода менее 0,02 % углерода и имеющий структуру 100 % феррита (Ф), называется техническим железом (Армко).
Для изменения химического состава и, соответственно, свойств стали в нужном направлении, в нее вводят специальные примеси, которые называются легирующими, а сами стали называются легированными.
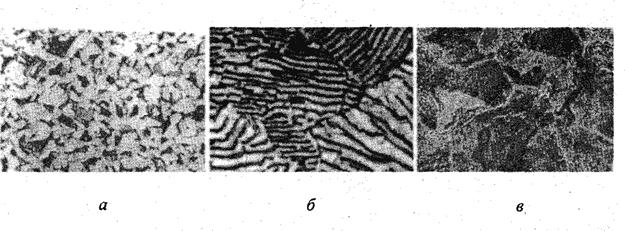
Рис. 7.2. Микроструктуры углеродистых сталей: а – доэвтектоидных; б – эвтектоидных; в – заэвтектоидных
Углеродистые стали – основной конструкционный материал, свойства которого зависят от количества углерода, структуры и содержания примесей. С ростом содержания углерода меняется структура, уменьшается количество феррита, увеличивается количество перлита, а, соответственно, увеличиваются прочность и твердость и уменьшается пластичность (рис. 7.3)
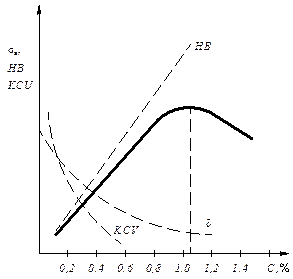
Рис. 7.3. Влияние углерода на механические свойства стали
Прочность стали (sВ) растет только до содержания углерода 1,0 %, а затем падает за счет образования сетки вторичного цементита по границам зерен (рис. 7.4).
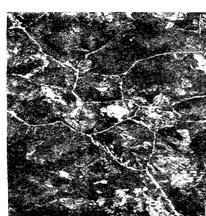
Рис. 7.4. Микроструктура стали с сеткой вторичного цементита по границам зерен
По способу выплавки стали делятся на мартеновскую, электросталь, выплавленную в электродуговых печах и конверторную, выплавленную в кислородно-конверторных печах.
По способу раскисления различают стали спокойные (сп), полуспокойные (псп), кипящие (кп).
По качеству, которое определяют постоянные в стали вредные примеси (S, P), стали делятся на стали общего назначения, качественные и высококачественные.
В конструкционных углеродистых сталях общего назначения допускается до 0,05 % серы и до 0,04 % фосфора. В качественных конструкционных сталях допускается содержание серы и фосфора менее 0,04 %. Высококачественные стали содержат серы и фосфора менее 0, 035 %. Особо высококачественные стали (только легированные) содержат серы менее 0,015 % и фосфора менее 0,025 %.
Сера нерастворима в железе и образует с ним химическое соединение FeS. Следствие чего – красноломкость, т.е. сталь становится хрупкой при повышенных температурах.
Фосфор растворяется в феррите, уменьшая пластичность, склонен к ликвации на границах зерен и вызывает хладноломкость.
Скрытые примеси (газы азот, кислород, водород), содержание которых составляет 10-2 - 10-4 %, ухудшают пластические свойства стали.
Знак качества обозначается буквой А и проставляется в конце обозначения марки стали. Например: сталь инструментальная У10А, содержащая 1 % углерода.
По назначению стали делятся на конструкционные и инструментальные.
5.3.2. Чугуны, в зависимости от того, в какой форме присутствует углерод в сплавах, различают белые, серые, высокопрочные и ковкие. Высокопрочные чугуны являются разновидностью серых, но из-за повышенных механических свойств их выделяют в особую группу.
Белыми называют чугуны, в которых весь углерод находится в связанном состоянии в виде цементита. Эти чугуны, фазовые превращения которых протекают согласно диаграмме состояния Fe – Fe3C, подразделяют на доэвтектические, эвтектические и заэвтектические.
Из-за большого количества цементита белые чугуны тверды (4500-5500 НВ), хрупки и для изготовления деталей машин мало используются. Ограниченное применение имеют отбеленные чугуны – отливки из серого чугуна со слоем белого чугуна в виде твердой корки на поверхности. Из них изготовляют прокатные валки, лемехи плугов, тормозные колодки и другие детали, работающие в условиях износа.
В промышленности широко применяют серые, высокопрочные и ковкие чугуны, в которых весь углерод или часть его находится в виде графита. Графит обеспечивает пониженную твердость, хорошую обрабатываемость резанием, а также высокие антифрикционные свойства вследствие низкого коэффициента трения. Вместе с тем включения графита снижают прочность и пластичность, так как нарушают сплошность металлической основы сплава. Серые, высокопрочные и ковкие чугуны различаются условиями образования графитных включений и их формой, что отражается на механических свойствах отливок.
Серыми называют чугуны с пластинчатой формой графита.
По химическому составу серые чугуны разделяют на обычные (нелегированные) и легированные. Обычные серые чугуны – сплавы сложного состава, содержащие основные элементы: Fe-C-Si и постоянные примеси: Mn, P, S. В небольших количествах в обычных чугунах может содержаться Cr, Ni и Cu, которые попадают из руды. Почти все эти элементы влияют на условия графитизации, количество графитных включений, структуру металлической основы и, как следствие, свойства чугуна.
Углерод оказывает определяющее влияние на качество чугуна, изменяя количество графита и литейные свойства. Чем выше концентрация углерода, тем больше выделений графита в чугуне и тем ниже его механические свойства.
Кремний обладает сильным графитизирующим действием; способствует выделению графита в процессе затвердевания чугуна и разложению выделившегося цементита.
Марганец затрудняет графитизацию чугуна, несколько улучшает его механические свойства, особенно в тонкостенных отливках.
Сера – вредная примесь. Она ухудшает механические и литейные свойства чугунов: понижает жидкотекучесть, увеличивает усадку и повышает склонность к образованию трещин.
Фосфор в количестве до 0,3 % растворяется в феррите. При большей концентрации он образует с железом и углеродом тройную «фосфидную» эвтектику. Она имеет низкую температуру плавления (950 оС), что увеличивает жидкотекучесть чугуна, но дает высокую твердость и хрупкость.
Таким образом, степень графитизации в чугуне возрастает с увеличением содержания углерода и кремния.
Кроме химического состава, структура чугуна и его свойства зависят от технологических факторов, главным из которых является скорость охлаждения. С уменьшением скорости охлаждения увеличивается количество графита, с увеличением – количество химически связанного углерода.
Ухудшая механические свойства, графит в то же время придает чугуну ряд ценных свойств. Он измельчает стружку при обработке резанием, оказывает смазывающее действие и, следовательно, повышает износостойкость чугуна, придает ему демпфирующую способность. Кроме того, пластинчатый графит обеспечивает малую чувствительность чугуна к дефектам поверхности. Благодаря этому сопротивление усталости деталей из чугуна соизмеримо со стальными деталями.
В чугунах с высоким содержанием кремния при медленном охлаждении отливки первичная кристаллизация происходит в соответствии со стабильной диаграммой Fe – C (рис. 7.1); в этом случае графит появляется непосредственно из жидкой фазы. С увеличением скорости охлаждения создаются условия для первичной кристаллизации в соответствии с метастабильной диаграммой Fe – Fe3C (рис. 7.1); из жидкой фазы выделяется цементит, а графит образуется вследствие его распада при дальнейшем охлаждении.
Чем крупнее и прямолинейнее форма графитовых включений, тем ниже сопротивление серого чугуна разрыву. И, наоборот, чем мельче и разобщеннее графитовые включения, тем меньше их отрицательное влияние.
По структуре металлической основы серые чугуны разделяют на три вида.
1. Серый перлитный со структурой (рис.7.5а) перлит + графит (рис. 7.6, область III). В этом чугуне количество связанного углерода составляет» 0,8 %.
2. Серый ферритно-перлитный со структурой (рис.7.5б) феррит + перлит + графит (рис.7.6, область IIIа). Количество связанного углерода в нем менее 0,8 %.
3. Серый ферритный со структурой (рис.7.5в) феррит + графит (рис.7.6, область IIIб). В это чугуне весь углерод находится в виде графита.
4.

Рис. 7.5. Микроструктуры серых чугунов: а – перлитного; б – ферритно-перлитного; в – ферритного
Рис. 7.6. Структурная диаграмма чугунов в зависимости от содержания кремния и углерода (а) и толщины стенки отливки (б): I – белый чугун; II – половинчатый чугун; III, IIIа, IIIб – серый перлитный, ферритно-перлитный и ферритный чугун соответственно
Механические свойства серого чугуна зависят от свойств металлической основы и, главным образом, количества, формы и размеров графитных включений. Прочность, твердость и износостойкость чугунов растут с увеличением количества перлита в металлической основе, которая по строению аналогична сталям. Решающее значение графита обусловлено тем, что его пластинки, прочность которых ничтожно мала, действуют как надрезы или трещины, пронизывающие металлическую основу и ослабляющие ее.
Номенклатура отливок из серого чугуна и их масса разнообразны: от деталей в несколько граммов (например, поршневые кольца двигателей) до отливок в 100 т и более (станины станков). Выбор марки чугунов для конкретных условий работы определяется совокупностью технологических и механических свойств (таблица 7.1).
Таблица 7.1
Механические свойства некоторых марок серых чугунов (ГОСТ 1412-85)
| Чугун | sв, МПа | d, % | НВ | Структура металлической основы |
| СЧ 15 СЧ 25 СЧ 40 СЧ 45 | - - - - | 1630-2290 1800-2500 2070-2850 2290-2890 | Феррит Феррит + перлит Перлит Перлит |
Марка серого чугуна состоит из букв СЧ (серый чугун) и цифры, показывающей значение временного сопротивления при растяжении в кгс/см2
Высокопрочными чугунами называют чугуны, в которых графит имеет шаровидную форму. Их получают модифицированием магнием, который вводят в жидкий чугун в количестве 0,02-0,08 %. Ввиду того, что модифицирование чугунов чистым магнием сопровождается сильным пироэффектом, чистый магний заменяют лигатурами (например, сплавом магния и никеля).
По структуре высокопрочный чугун может быть ферритным, ферритно-перлитным или перлитным (рис.7.7).

Рис. 7.7. Микроструктура высокопрочного чугуна, (х 300): а – ферритный; б - ферритно-перлитный; в – перлитный
Шаровидный графит – менее сильный концентратор напряжений, чем пластинчатый графит, и поэтому меньше снижает механические свойства основы. Чугуны с шаровидным графитом обладают более высокой прочностью и некоторой пластичностью. Маркируют высокопрочные чугуны по пределу прочности и относительному удлинению (таблица 7.2).
Таблица 7.2
Механические свойства некоторых высокопрочных чугунов
(ГОСТ 7293-85)
| Чугун | sв, МПа | d, % | НВ | Структура металлической основы |
| ВЧ 38-17 ВЧ 42-12 ВЧ 50-7 ВЧ 60-2 ВЧ 80-2 ВЧ 120-2 | 1400-1700 1400-2000 1710-2410 2000-2800 2500-3300 3020-3800 | Феррит с небольшим количеством перлита Перлит с небольшим количеством феррита |
Высокопрочные чугуны применяют в различных отраслях техники, эффективно заменяя сталь во многих изделиях и конструкциях. Из них изготовляют оборудование прокатных станов (прокатные валки массой 12 т), кузнечно-прессовое оборудование (траверса пресса, шабот ковочного молота), в турбостроении – корпус паровой турбины, лопатки направляющего аппарата, в дизеле-, тракторо- и автомобилестроении – коленчатые валы, поршни и многие другие ответственные детали, работающие при высоких циклических нагрузках и условиях изнашивания.
В некоторых случаях для улучшения механических свойств применяют термическую обработку отливок; для повышения прочности – закалку и отпуск при 500-600 оС; для увеличения пластичности – отжиг, способствующий сфероидизации перлита.
Ковкими называют чугуны, в которых графит имеет хлопьевидную форму. Их получают отжигом белых доэвтектических чугунов. По этой причине графит ковких чугунов называют углеродом отжига. Такой графит, в отличие от пластинчатого, меньше снижает механические свойства металлической основы, вследствие чего ковкий чугун по сравнению с серым обладает более высокой прочностью и пластичностью.
Отливки из белого чугуна, подвергаемые отжигу на ковкий чугун, изготовляют тонкостенными. Они не должны иметь сечение более 50 мм, иначе в сердцевине при кристаллизации выделяется пластинчатый графит, чугун становится непригодным для отжига.
По структуре металлической основы, которая определяется режимом отжига, ковкие чугуны бывают ферритными и перлитными (рис. 7.8).

Рис. 7.8. Микроструктура ковких чугунов, (х 300): а – ферритный; б – ферритно – перлитный; в - перлитный
Отжиг на ферритные чугуны проводят по режиму 1 (рис. 7.9), обеспечивающему графитизацию всех видов цементита белого чугуна. Перлитный ковкий чугун получают отжигом, который проводят в окислительной среде по режиму 2 (рис. 7.9).
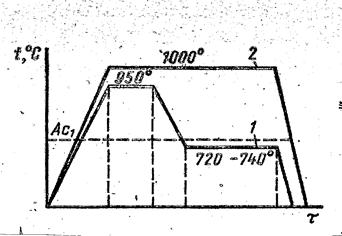
Рис. 7.9. Схема отжига белого чугуна на ковкий: 1 – на ферритный;
2 – на перлитный
Графитизация цементита перлита практически не происходит, чугун приобретает структуру, состоящую из перлита и углерода отжига. Отсутствие литейных напряжений, которые полностью снимаются во время отжига, компактная форма и изолированность графитных включений обусловливают высокие механические свойства ковких чугунов. Принцип их маркировки тот же, что и высокопрочных чугунов: КЧ sв - d (таблица 7.3).
Таблица 7.3
Механические свойства некоторых марок ковких чугунов (ГОСТ 1215-79)
| Чугун | sв, МПа | d, % | НВ | Структура металлической основы |
| КЧ 30-6 КЧ 35-10 КЧ 37-12 КЧ 45-7 КЧ 60-3 КЧ 80-1,5 | 1,5 | 1000-1630 1000-1630 1100-1630 1500-2070 2000-2690 2700-3200 | Феррит + (10-3 %) перлита Перлит + (20-0 %) феррита |
Из таблицы видно, что ферритные чугуны имеют более высокую пластичность, а перлитные – более высокую прочность и твердость.
Ковкие чугуны нашли широкое применение в сельскохозяйственном, автомобильном и текстильном машиностроении, в судо-, котло-, вагоно- и дизелестроении. Из них изготовляют детали высокой прочности, работающие в тяжелых условиях износа, способные воспринимать ударные и знакопеременные нагрузки. Большая плотность отливок ковкого чугуна позволяет изготовлять детали водо- и газопроводных установок; хорошие литейные свойства исходного белого чугуна – отливки сложной формы.
Недостаток ковких чугунов – повышенная стоимость из-за продолжительного дорогостоящего отжига.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 7457; Нарушение авторских прав?; Мы поможем в написании вашей работы!