
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Очистка газов от оксидов углерода СО2 и СО
|
|
|
|
Оксиды углерода СО2 и СО в воздухе присутствуют в газообразном состоянии. Продолжительность их пребывания в приземном слое атмосферы определяется свойствами оксидов и параметрами среды (температура, давление, влажность и т.п.). Оксид углерода СО2 значительно легче, чем СО, выводится из атмосферы в процессе ее самоочищения. Оксид углерода СО чрезвычайно токсичен, переносится на большие расстояния от источников выброса, долго может находиться в неизменном виде в приземном слое атмосферы. Очистка промышленных газов от СО2 и СО основана на их физических и химических свойствах.
Оксид углерода (IU) – это бесцветный газ со слегка кисловатым запахом и вкусом. В воде СО2 растворим довольно хорошо (приблизительно 1:1 по объему). По химической природе это кислотный оксид, взаимодействующий с водой при растворении в ней, основаниями (щелочами), основными оксидами. При растворении СО2 в воде образуется слабая угольная кислота:
Н2О + СО2 = Н2 СО3 .
Н2О + СО2 = Н2 СО3 = Н+ + НСО3¯ = 2 Н+ + СО3 2 ¯
При нагревании СО2 улетучивается и равновесия смещаются влево. При добавлении щелочи или щелочных реагентов равновесия смещаются вправо. Образующиеся карбонаты и гидрокарбонаты имеют различную растворимость в воде, не токсичны.
Оксид углерода (II) – бесцветный газ, не имеющий запаха и вкуса, плохо растворим в воде. Газ сильно токсичен, его ПДК в воздухе населенных мест 1 мг/м3. Основная опасность СО для животных и человека обусловлена его способностью связываться с гемоглобином крови легче, чем кислород. Большая токсичность СО обусловливает необходимость тщательной очистки от него промышленных газов, выбрасываемых в атмосферу. При очистке загрязненных газов от СО используются следующие его свойства: возможность окисления СО до СО2; способность СО вступать в реакции комплексообразования.
Таблица 3
Методы очистки газов от оксидов углерода
| метод | основные процессы метода |
| Абсорбция СО2 водой | абсорбция: СО2 + Н2О = Н2СО3 регенерация сорбента: Н2СО3 = Н2О + СО2 |
| Абсорбция СО2 этаноламином | абсорбция: (RNH3)2 СО3 + СО2 + Н2О = 2 (RNH3)НСО3 регенерация сорбента: 2 (RNH3)НСО3 = (RNH3)2 СО3 + СО2 + Н2О |
| Метанирование СО и СО2 | СО + 3 Н2 = СН4 + Н2О СО2 + 4 Н2 = СН4 + 2 Н2О (катализатор на основе оксидов NiO, Al2O3) |
| Абсорбция медноаммиачным раствором СО и СО2 | абсорбция: [ Cu(NH3)2]+ + CO + NH3 = [ Cu(NH3)3CO]+ регенерация сорбента: [ Cu(NH3)3CO]+ = [ Cu(NH3)2]+ + CO + NH3 NH3 + Н2О = NH4OH 2NH4OH + СО2 = (NH4)2 CO3 + Н2О (NH4)2 CO3 + СО2 + Н2О = 2NH4HCO3 |
| Конверсия СО с водяным паром | СО + Н2О = СО2 + Н2 (катализатор на основе оксидов железа) |
Абсорбция СО2 водой - один из простейших методов очистки газообразных выбросов от оксида углерода (IU).Максимальная поглотительная способность воды 8 кг СО2 на 100 кг воды. Очищенный газ выводится в атмосферу. Раствор СО2 в воде перекачивается в дегазатор, где СО2 выделяется из раствора и выводится из аппарата для дальнейшего использования или химической переработки. Вода из дегазатора подается в поглотительную колонну для использования в следующем аналогичном цикле.

 Н2О
Н2О
 газ СО2
газ СО2






 (2)
(2)
 | |||
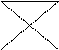 | |||
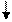



 газ+ СО2 (1) (3)
газ+ СО2 (1) (3)











 (2)
(2)
Н2О + СО2 Н2О
1 – колонна высокого давления,
2 – устройства для перекачки жидкостей (вода, раствор)
3 – дегазатор
Схема абсорбционной очистки газов от СО2.
Основные преимущества данного метода заключаются в следующем: отсутствие токсичных отходов, выбрасываемых в природные среды; экономичность; доступность растворителя – воды, относительная простота технологического процесса и применяемых аппаратов. К существенным недостаткам метода относится небольшая поглотительная емкость воды по СО2, недостаточная чистота выделяемого СО2.
Абсорбция СО2 этаноламинами обладает рядом преимуществ по сравнению с абсорбцией СО2 водой и является наиболее распространенным методом очистки промышленных газообразных выбросов от этого компонента. Большая по сравнению с водой эффективность этаноламинов обусловлена, прежде всего, наличием щелочных свойств у моно-, ди- и триэтаноламинов (МЭА, ДЭА, ТЭА). Как следствие, данные растворители способны эффективно поглощать из загрязненных газовых сред не только СО2 , но и другие загрязнения, обладающие кислотными свойствами, например, сероводород. Моноэтаноламин хорошо поглощает также оксид углерода (II).
2 RNH2 + 2 Н+ + СО3 2 ¯ = (RNH3)2 СО3
(RNH3)2 СО3 + СО2 + Н2О = 2 (RNH3)НСО3
2 RNH2 + Н2S = (RNH3)2 S
(RNH3)2 S + Н2S = 2 (RNH3)HS
RNH2 моноэтаноламин (МЭА, R – этил С2Н5);
R2NH диэтаноламин (ДЭА);
R3N триэтаноламин (ТЭА).
В промышленности чаще применяют моноэтаноламин как абсорбент, эффективный по отношению к нескольким компонентам, недорогой, легко поддающийся регенерации. Технологическая схема процесса обычная для абсорбционных процессов.
Метанирование СО и СО2 применяется для очистки газов, содержащих небольшие остаточные количества СО. Очистка газов основана на экзотермической реакции гидрирования СО в присутствии катализаторов. Одновременно из очищаемого газа удаляется СО2 и кислород. Образующийся метан может далее сжигаться, если не используется в технологическом процессе.
Абсорбция СО и СО2 медноаммиачным раствором используется для глубокой очистки газов от СО. Процесс основан на способности комплексного медно-аммиачного соединения поглощать СО под высоким давлением с образованием соответствующего комплексного соединения
[Cu(NH3)3CO]+. При нагревании последнего СО легко удаляется, что объясняет возможность легкой регенерации поглотительного раствора. Улавливаемы оксид углерода СО следует далее на другие ступени очистки (например, на окисление до СО2). Процесс абсорбции проводят при высоком давлении и температуре, близкой к 0ОС. Десорбцию СО проводят при атмосферном давлении и температуре» 80ОС. Технологическая схема процесса обычная для абсорбционных процессов.
Конверсия СО с водяным паром. О кисление СО до СО2 в промышленных условиях проводится с использованием различных реагентов, но наиболее распространенными реагентами являются водяной пар и метан. Конверсия СО с водяным паром проводится в присутствии железных окисных катализаторов (Fe2O3 + Cr2O3), реакция СО + Н2О = СО2 + Н2 экзотермична.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 5265; Нарушение авторских прав?; Мы поможем в написании вашей работы!