
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
Айналымды процессте пайдалы жұмысқа жұмыстық денеге берілген жылцдың тек Q1–Q2–бөлігі пайдалы жұмысқа жұмсалады.
Демек, неғұрлым Q2 аз болса, соғұрлым пайдалы жұмыс көп болады. Q2 неден байланысты екенін қарастырып көрейік.
ηпәк=(q1–q2)/q1=1–(q2/q1)=1–(Т2/Т1); (q2/q1)=(Т2/Т1); q2= q1Т2/Т1
 мұндағы Т2 – жылу қвбылдайтын дененің температурасы бұл температура аз мөлшерде өзгереді. Сондықтан оны тұрақты деп қабылдауға болады. Бұл жағдайда q2= q1/Т1 қатынасы келтірілген жылулық немесе этропия деп айтады.
мұндағы Т2 – жылу қвбылдайтын дененің температурасы бұл температура аз мөлшерде өзгереді. Сондықтан оны тұрақты деп қабылдауға болады. Бұл жағдайда q2= q1/Т1 қатынасы келтірілген жылулық немесе этропия деп айтады.
Өте аз dq жылу берейік. Аз мөлшерде жұмыстық дене өте аз дылу нәтижесінде 1–2 процессін шексіз кіші бөлшектерге бөлейік. Бұл бөлшектердің арасындағы температура өзгерісі const деп алайық. dq/T=dS.
1–2 процессіндегі энтропия өзгеруін былай табуға болады.
dq= cvdT+ pdv
 ; PV=RT осы теңдеуден P/T=R/V.
; PV=RT осы теңдеуден P/T=R/V.


Демек энтропия өзгерісі жұмыстық дененің бастапқы және ақырғы күйіне байланысты. Жұмыс процессіне байланысты емес.
dq/T=dS теңдеуден
dq›0 Þ Δ S›0 dq‹0 Þ Δ S‹0 dq=0 Þ Δ S=0
Идеал газдардың күй өзгеру процесстері
Изохоралық процесс. v=const немесе dv=0.
 dq=du+dℓ q=Δu+ℓ dv=0 dℓ =0 dq=du q=Δu=u2–u1,
dq=du+dℓ q=Δu+ℓ dv=0 dℓ =0 dq=du q=Δu=u2–u1,
Демек изохоралық процессте пайдалы жұмыс жасалмайды. Денеге берілген жылу ол дененің ішкі энергиясын өзгертуге жұмсалады.
q=сm(t2– t1)
Δu=u2–u1=сm(t2– t1)
Изобаралық процесс. р=const немесе dр=0.
 р=const болса жұмыстық дененің көлемі көбейеді.
р=const болса жұмыстық дененің көлемі көбейеді.
q=Δu+ℓ; Δu=cvdT; ℓ=P(V2–V1)=R(T2–T1);
q=cvdT+R(T2–T1)=(cv+R; q=cр(T2–T1)= cрΔТ.
Изобаралық процессте жұмыстық денеге берілген жылу ол дененің ішкі энергиясын өзгертіге және пайдалы жұмыс жасауға жұмсалады.
 Изотермиялық процесс. Тұрақты температура өтетін процесс. Т=const немесе dТ=0. pv=const.
Изотермиялық процесс. Тұрақты температура өтетін процесс. Т=const немесе dТ=0. pv=const.
q=Δu+ℓ; u=f(t) Δu=0 демек q=ℓ;
Демек изотермиялық құыбылыста жұмыстық дененің ішкі энергиясы өзгермейді жұмыстық денеге жұмсалынған жылу пайдалы жұмыс жасайды. 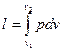 ; pv=RT Þ р=RT/v
; pv=RT Þ р=RT/v


Адиабаттық құбылыс. Қоршаған ортамен жылу алмасу құбылысы сырттан жылу алмайды, сыртқа жылу бермейді – адиабаттық құбылыс. dq=0
Адиабаттық құбылыста пайдалы жұмыс жұмыстық дененің ішкі энергиясының кемуінің нәтижесінде жасалынады.
 ; dq=0; q=Δu+ℓ; Δu+ℓ =0; Δu = – ℓ.
; dq=0; q=Δu+ℓ; Δu+ℓ =0; Δu = – ℓ.
Δu=cvdT=cv(T2–Т1)
ℓ = cv(T1–Т2) Т= pv/R
ℓ = cv(p1 v1– p2 v2 /R) = cv(p1 v1– p2 v2)/R;
ср–cv = R Майер теңдеунен ср›cv
ℓ = cv(p1 v1– p2 v2)/R = cv(p1 v1– p2 v2)/ ср–cv
 ср/сv = k
ср/сv = k 
ℓ=P(V2–V1)=R(T2–T1)
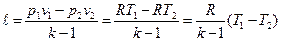

k=1,62 – бір атомдық молекула үшін
k=1,4 – екі атомдық молекула үшін
k=1,29 – үш атомдық молекула ұшін.
Политроптық процесс. Политроптық құбылыс деп жылу сыйымдылығы қандай да бір мөлшерде, бірақ құбылыс бойынша тұрақты болған құбылысты атайды.
pvn=const
n=k, pvn=pvk адиабаттық процесс,
n=0, pvn= pv0=p изобаралық процесс,
n=1, pvn= pv1= RТ изотермиялық процесс,
n=±∞, pvn= pv∞ изохоралық процесс.
Политроп теңдеу адиабаттық теңдеунен тек дәрежесінде айырмашылығы болған, политроптық теңдеу адиабаттық теңдеулерге шығарылған формуларымен анықталады
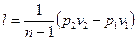

 .
.
Су буы, жалпы түсінік
Сүйық буға қайнау және булану процессетерінде айналады. Булану процессі дегеніміз судың бетінен, кез келген температурасы болатын жағдайды айтады. Булану процессінін қарқындылығы оның температурасына және оның табиғатына байланысты. Белгілі бір температурада табиғатына және қысымға байланысты сүйықтың бүкіл масса бойынша бу пайда болады, мұны қайнау процессі деп айтады. Қайнау процессінде будың қысымы судың қысымына тең. Булану процессіне кері процессті конденсация деп айтады. Бу суға айналған кезде температурасы тұрақты болған жағдайда оның қысымы да тұрақты. Будан айналған сүйықты конденсат деп айтады.
Ылғалды қаныққан бу деп су үстіндегі буды айтады. Будың негізгі қасиеті оның температурасы қысыммен байланысты болғандықтан булану процессінде будың қысымы сүйықтын қысымына тең, сондықтан қайнау температурасы қанығу температурасы деп атауға болады. Сүйықтың соңғы тамшысы буға айналган кезде булану процессі аяқталады. Бұл буды құрғақ қаныққын бу деп атайды. Қаныққан ылғал бу - құрғақ бу су тамшыларымен бүкіл көлемі бойынша араласқан қоспаны айтады. Құрғақ будың салмақтық үлесі ылғал буда құрғақ дәрежесі немесе көрсеткіші деп аталады. х-будың құрғақтық көрсеткіші.
Қысымы тұрақты будың температурасы құрғақ қаныққан будың температурасынан жоғары болған жағдайда өте қызған бу деп айтады.
Су буының pv-диаграммасы
Булану процессін қысымы тұрақты болған жағдайда қарастырайық. 1 кг суды температурасы 0оС цилиндр ішіндегі поршеньнің астына орналыстырайық. Судың бастапқы күйі а нүктесімен белгіленген. Егер қысымы тұрақты суды қыздырған кезде оның көлемі ұлғайяды, в нүктесінде қайнау процессі басталады. Диаграммада в-с сызығын булану процессі деп атайды. с нүктесінде булану процессі аяқталады (соңғы судың тамшысы буға айналады). Бұл нүктеге сәікес бу қаныққан құрғақ бу деп атайды.
 Ал енді алдынғы тәжирібені қайта бастайық поршенді цилиндрге су құйып қысымы сәл жоғары болған жағдайды қарастырайық. Осы тәжирібені бір неше рет қайталайық. Әрбір тәжирібеде судың бастапқы күйін а нүктесімен, булану процессінің басталуын в нүктесімен, булану процессінің аяқталуы с нүктесімен белгілейік. Енді диаграммада аттас нүктелерді қосайық. Диаграммада үш сызық аламыз. Ι–сызық судың меншікті көлемі. Судың меншікті көлемі оның қысымына байланысты емес. Сондықтан а нүктесі диаграммада вертикаль сызық. Диаграммадан қысым артқансайын ΙΙ және ΙΙΙ–сызықтар бір біріне жақындап К нүктесінде кездескенің көреміз. К-критикалық нүкте деп аталады. Критикалық нүктедегі параметрлер критикалық деп аталады (Ркр, νкр, Ткр). Критикалық нүктеде судың және будың қасиетінің айырмашылығы жойылады. Критикалық нүктеде заттың агрегаттың күйі өзгерседе күй параметрілері өзгермейді. ΙΙ–сызық в, в', в'' нүктелерін қосқанда, қайнаған судың күйіне сәікес болады. ΙΙΙ–сызық с, с', с'' нүктелерін қосқанда, қаныққан құрғақ будың күйіне сәікес болады. 1кг суды қайнау температурасынан қаныққан құрғақ буға айналдырғанда қысымы жоғарлағансайын оның меншікті көлемі азаяды. Егер қаныққан құрғақ буға жылу берсек оның температурасы арттады мұндай буды өте қыздырылған бу деп атайды диаграммада с–d сызығымен көрсетілген, d нүктеде өте қыздырылған бу. Ι мен ΙΙ сызықтардың арасында судың аймағы, ΙΙ мен ΙΙΙ сызықтардың арасында құрғақ дәрежесі әр түрлі қаныққан ылғал будың аймағы, ΙΙΙ сызықтың он жағында өте қыздырылған будың аймағы.
Ал енді алдынғы тәжирібені қайта бастайық поршенді цилиндрге су құйып қысымы сәл жоғары болған жағдайды қарастырайық. Осы тәжирібені бір неше рет қайталайық. Әрбір тәжирібеде судың бастапқы күйін а нүктесімен, булану процессінің басталуын в нүктесімен, булану процессінің аяқталуы с нүктесімен белгілейік. Енді диаграммада аттас нүктелерді қосайық. Диаграммада үш сызық аламыз. Ι–сызық судың меншікті көлемі. Судың меншікті көлемі оның қысымына байланысты емес. Сондықтан а нүктесі диаграммада вертикаль сызық. Диаграммадан қысым артқансайын ΙΙ және ΙΙΙ–сызықтар бір біріне жақындап К нүктесінде кездескенің көреміз. К-критикалық нүкте деп аталады. Критикалық нүктедегі параметрлер критикалық деп аталады (Ркр, νкр, Ткр). Критикалық нүктеде судың және будың қасиетінің айырмашылығы жойылады. Критикалық нүктеде заттың агрегаттың күйі өзгерседе күй параметрілері өзгермейді. ΙΙ–сызық в, в', в'' нүктелерін қосқанда, қайнаған судың күйіне сәікес болады. ΙΙΙ–сызық с, с', с'' нүктелерін қосқанда, қаныққан құрғақ будың күйіне сәікес болады. 1кг суды қайнау температурасынан қаныққан құрғақ буға айналдырғанда қысымы жоғарлағансайын оның меншікті көлемі азаяды. Егер қаныққан құрғақ буға жылу берсек оның температурасы арттады мұндай буды өте қыздырылған бу деп атайды диаграммада с–d сызығымен көрсетілген, d нүктеде өте қыздырылған бу. Ι мен ΙΙ сызықтардың арасында судың аймағы, ΙΙ мен ΙΙΙ сызықтардың арасында құрғақ дәрежесі әр түрлі қаныққан ылғал будың аймағы, ΙΙΙ сызықтың он жағында өте қыздырылған будың аймағы.
Қаныққан құрғақ будың күйін анықтау үшін тек бір параметр белгілі болса жеткілікті. Ал қаныққан ылғал будың күйін анықтау үшін қосымша құрғақ дәрежесі белгілі болуы керек.
Су буының TS-диаграммасы

 TS-диаграммасында қысым тұрақты болған жағдайдағы суды қыздыру процессі ав сызығымен көрсетіледі. Булану процессін қарастырғанда булану басталуынан булану процессі бетікенге дейін температура тұрақты болатын айтқанбіз. TS-диаграммасында вс сызығы буланудың басталуын және с нүктесінде буланудың аяқталуын көрсетеді. с нүктесіндегі бу қаныққан құрғақ бу. Берілген жылу әсерінен қаныққан құрғақ будың температурасы арттады (cd сызығы). всd нүктелерінен абцисса өсіне вертикаль түсірсек диаграммада үш аудан аламыз. 1 аудан 0авВ қыздырылған судың энтальпиясы. 2 аудан ВвсС буланыдың жасырынды жылуы. Буланудың жасырынды жылуы деп 1кг қайнаған суды берілген қысымда толығымен буға айналдыруға қажетті жылу мөлшерін атайды. Аудан СсdD қаныққан құрғақ буды өте қызған буға айналдыруға жұмсалынған жылу мөлшері. Су буына байланысты есептерді шешу үшін TS-диаграммасымен былайша пайдаланады. Су буының бастапқы және ақырғы қүйі үшін қабылдаңған масштабта су буының диаграммасын түзеді. Сонан сон қажетті аудандардың айырмашылығын анықтайды. Анықталған айырмашылықты қабылданған мсштабқа көбейтеді. Осылайша есепті шешеді. Бұл тәсіл өте қиын. Сондықтан су буына байланысты есепті шешкенде су буының і–s-диаграммасын пайдаланады.
TS-диаграммасында қысым тұрақты болған жағдайдағы суды қыздыру процессі ав сызығымен көрсетіледі. Булану процессін қарастырғанда булану басталуынан булану процессі бетікенге дейін температура тұрақты болатын айтқанбіз. TS-диаграммасында вс сызығы буланудың басталуын және с нүктесінде буланудың аяқталуын көрсетеді. с нүктесіндегі бу қаныққан құрғақ бу. Берілген жылу әсерінен қаныққан құрғақ будың температурасы арттады (cd сызығы). всd нүктелерінен абцисса өсіне вертикаль түсірсек диаграммада үш аудан аламыз. 1 аудан 0авВ қыздырылған судың энтальпиясы. 2 аудан ВвсС буланыдың жасырынды жылуы. Буланудың жасырынды жылуы деп 1кг қайнаған суды берілген қысымда толығымен буға айналдыруға қажетті жылу мөлшерін атайды. Аудан СсdD қаныққан құрғақ буды өте қызған буға айналдыруға жұмсалынған жылу мөлшері. Су буына байланысты есептерді шешу үшін TS-диаграммасымен былайша пайдаланады. Су буының бастапқы және ақырғы қүйі үшін қабылдаңған масштабта су буының диаграммасын түзеді. Сонан сон қажетті аудандардың айырмашылығын анықтайды. Анықталған айырмашылықты қабылданған мсштабқа көбейтеді. Осылайша есепті шешеді. Бұл тәсіл өте қиын. Сондықтан су буына байланысты есепті шешкенде су буының і–s-диаграммасын пайдаланады.
Су буының iS- диаграммасы
Есеп шығарғанда iS- диаграммасымен қолданған жөн.
Ол үшін абциссада энтропия, ординатада энтальпия белгіленген, 1-К-2 сызығының астында қаныққан ылғал бу, жоғары өте қыздырылыған бу, ал К-2 сызық қаныққан құрғақ бу, 1-К сызық – қайнаған су. Қаныққан ылғал будың аймағында изобара мен изотерманың процесстері бір сызықта жатады. Өте қыздырылған будың аймағында изобара сызығы жоғары кетеді, ал изотерма сызығы онға қарай кетеді.
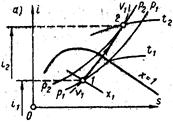 Су буының изохоралық процессін iS- диаграммасында қарастырайық. Будың бастапқы р1 и х1 параметрлері белгілі болған жағдайда 1 нүктеден изохоралық процесспен температурасы t2 өзгерту керек. Изохоралық процессте ылғал буға жылу берген кезде оның қысымы және температурасы жоғарлайды. Бұл жағдайда будың ылғалдығы азаяды да ол қаныққан құрғақ буға сонан кейін өте қыздырылған буға айналады. Өте қыздырылған будан жылуды алған кезде процесс кері бағытта жүреді.
Су буының изохоралық процессін iS- диаграммасында қарастырайық. Будың бастапқы р1 и х1 параметрлері белгілі болған жағдайда 1 нүктеден изохоралық процесспен температурасы t2 өзгерту керек. Изохоралық процессте ылғал буға жылу берген кезде оның қысымы және температурасы жоғарлайды. Бұл жағдайда будың ылғалдығы азаяды да ол қаныққан құрғақ буға сонан кейін өте қыздырылған буға айналады. Өте қыздырылған будан жылуды алған кезде процесс кері бағытта жүреді.
 Су буының изобаралық процессін iS- диаграммасында қарастырайық. Будың бастапқы р1 и х1 параметрлері белгілі болған жағдайда 1 нүктеден изобаралық процесспен температурасы t2 өзгерту керек. Изобаралық процессте ылғал буға жылу берген кезде оның ылғалдығы азаяды да ол қаныққан құрғақ буға айналады бірақ оның температурасы өзгермейді ол қанығу температурасына сәікес болады. Ал өте қыздырылған буға айналған да оның температурасы жоғарлайды. Өте қыздырылған будан жылуды алған кезде процесс кері бағытта жүреді.
Су буының изобаралық процессін iS- диаграммасында қарастырайық. Будың бастапқы р1 и х1 параметрлері белгілі болған жағдайда 1 нүктеден изобаралық процесспен температурасы t2 өзгерту керек. Изобаралық процессте ылғал буға жылу берген кезде оның ылғалдығы азаяды да ол қаныққан құрғақ буға айналады бірақ оның температурасы өзгермейді ол қанығу температурасына сәікес болады. Ал өте қыздырылған буға айналған да оның температурасы жоғарлайды. Өте қыздырылған будан жылуды алған кезде процесс кері бағытта жүреді.
Су буының изотермиялық процессін iS- диаграммасында қарастырайық. Будың бастапқы параметрлері р1, х1 ақырғы параметрі р2 болсын. Диаграммада р1, х1 қиылсқан нүктеден изотерма бойымен р2 дейін өзгертеміз. Изотермиялық процессте ылғал буға жылу берген кезде оның  көлемі ұлғаяды да ол қаныққан құрғақ буға сонан кейін өте қыздырылған буға айналады. Изотермиялық процессте қаныққан ылғалды будың аймағында изотерма изобарамен бір сызықта жатады. Өте қыздырылған буға айналған кезде изотермиялық процессте будың қысымы төмендейді. Өте қыздырылған будан жылуды алған кезде процесс кері бағытта жүреді.
көлемі ұлғаяды да ол қаныққан құрғақ буға сонан кейін өте қыздырылған буға айналады. Изотермиялық процессте қаныққан ылғалды будың аймағында изотерма изобарамен бір сызықта жатады. Өте қыздырылған буға айналған кезде изотермиялық процессте будың қысымы төмендейді. Өте қыздырылған будан жылуды алған кезде процесс кері бағытта жүреді.
 Су буының адиабаттық процессін iS- диаграммасында қарастырайық. Будың бастапқы параметрлері р1 и t1 ақырғы қысымы р2 берілсе диаграммада 1 нүктеден өтетін адиабатамен р2 қыйылысқан нүктесін анықтаймыз. Адиабаттық процессте су буының энтропиясы тұрақты болады. Адиабаттық ұлғаю кезінде будың қысымы және температурасы төмендейді, қаныққан құрғақ буға сонан кейін ылғал буға айналады. Ылғал буды адиабаттық сыққан кезде процесс кері бағытта жүреді.
Су буының адиабаттық процессін iS- диаграммасында қарастырайық. Будың бастапқы параметрлері р1 и t1 ақырғы қысымы р2 берілсе диаграммада 1 нүктеден өтетін адиабатамен р2 қыйылысқан нүктесін анықтаймыз. Адиабаттық процессте су буының энтропиясы тұрақты болады. Адиабаттық ұлғаю кезінде будың қысымы және температурасы төмендейді, қаныққан құрғақ буға сонан кейін ылғал буға айналады. Ылғал буды адиабаттық сыққан кезде процесс кері бағытта жүреді.
Су буының Карно циклі
 1-қазан, 2-бу қыздырғыш, 3-бу турбинасы, 4-электрогенератор, 5-конденсатор, 6-конденсаттық насос, 7-қоректік бак, 8-қоректік насос, 9-су қыздырғыш (экономайзер).
1-қазан, 2-бу қыздырғыш, 3-бу турбинасы, 4-электрогенератор, 5-конденсатор, 6-конденсаттық насос, 7-қоректік бак, 8-қоректік насос, 9-су қыздырғыш (экономайзер).
Бутурбиналық қондырғыларда жұмыс алу процессі былайша өтеді. Отын жанған кезде оның химиялық энергиясы жану өнімдерінің ішкі энергиясына айналады, бұл энергия жылу түрінде қазандағы 1 суға және қыздырғыштағы буға тасымалданады. Қыздырылған бу турбина 3-ке бағытталады, осы турбинада жылулық механикалық жұмысқа айналады, механикалық жұмыс электрогенераторда 4 электроэнергия айналады. Жұмыс істеген бу конденсатор 5-ке бағытталып бұл жерде жылулығын салқындататын суға беріп конденсатқа айналады. Алынған конденсат конденсаттық насоспен 6 қоректі бакқа 7 бағытталады. Қоректі насоспен қоректі суды қыздырғыштан өткізіп бу қазанына 1 беріледі.
 Карно циклі ең идеалды цикл деп саналады. Сүреттегі қаныққан ылғалды будың Карно циклі көрсетілген. О нүктесі қайнаған судың бастапқы күйі. қысымы р1 сипаттайды.
Карно циклі ең идеалды цикл деп саналады. Сүреттегі қаныққан ылғалды будың Карно циклі көрсетілген. О нүктесі қайнаған судың бастапқы күйі. қысымы р1 сипаттайды.
|
Дата добавления: 2014-01-05; Просмотров: 3086; Нарушение авторских прав?; Мы поможем в написании вашей работы!