
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрическое определение рН
|
|
|
|
ПРИМЕНЕНИЕ ПОТЕНЦИОМЕТРИЧЕСКИХ МЕТОДОВ
Определение каких-нибудь свойств путем измерения ЭДС гальванических цепей того или другого вида называют потенциометрическими определениями. Наиболее важными из них можно назвать:
1. Определение термодинамических параметров химических реакций.
2. Определение растворимости малорастворимых электролитов.
3. Определение рН и потенциометрическое титрование.
Потенциал водородного электрода связан простым соотношением с активностью водородных ионов
. jН+ = lnaH+
и с водородным показателем среды рН
jН+ = -1,984×10-4 Т (рН),
что дает возможность определять аН+ и рН путем измерения ЭДС соответствующих цепей, содержащих водородный электрод. Наряду с водородным электродом для той же цели может служить хингидронный электрод, стеклянный и некоторые другие электроды.
Хингидронный электрод
Для измерения рН растворов широко применяется хинон-гидрохиноновый (хингидронный) редокс-электрод.
При рН < 8 на платине протекает электродная реакция:
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2;
jхинг = j0 + lg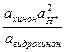 .
.
При измерении рН среды в испытуемый раcтвор, насыщенный эквимолекулярной смесью хинона и гидрохинона, погружают платиновую проволочку. Так как ахинон = агидрохинон уравнение принимает вид
jхинг = j0 + в0lg aH+ = 0,699 – в0 рН.
СТЕКЛЯННЫЙ ЭЛЕКТРОД
Этот электрод представляет собой стеклянную мембрану, разделяющую два раствора с различной концентрацией ионов водорода. При этом на поверхности стекла возникает скачок потенциала.
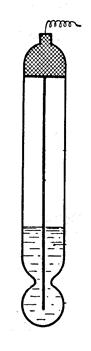
Стекло представляет coбой сетку, построенную из кремнийкислородных цепочек, пустоты которой заняты катионами щелочных металлов. Катионы, находящиеся в пустотах решетки, могут обратимо замениться без нарушения структуры решетки.
В возникновении водородной функции в растворах большую роль играет обмен ионов щелочных металлов, находящихся в промежутках кремнийкислородной решетки, на ионы из раствора, в который погружен стеклянный электрод. Стеклянный электрод отличается от других электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Электродная реакция сводится здесь к обмену ионами водорода между двумя фазами - раствором и стеклом:
Н+ = Н+ст.
Уравнение для потенциала стеклянного электрода запишется таким oбразом:
jст = j0 + 2,303 lg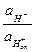 .
.
Уравнение реакции обмена будет следующим:
Ме+ст + Н+ = Ме+ + Н+ст,
где ионы Ме+, в зависимости от состава стекла, могут быть ионы Na+ или К+.
Этому уравнению соответствует константа обмена
Кобм = 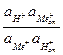 .
.
Если предположить, что в стекле данного сорта сумма активностей ионов водорода и щелочного металла постоянна аН+ст + аМе+ст = а, то константа обмена примет вид
Кобм = 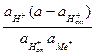 .
.
Решение относительно 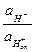 дает
дает
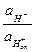 =
= 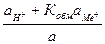 .
.
Подстановка в уравнение для электродного потенциала дает
jст = j0ст + в0 lg(aH+ + KобмаМе+),
где величина 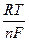 lna включена в стандартный потенциал стеклянного электрода.
lna включена в стандартный потенциал стеклянного электрода.
Для обычных стеклянных электродов величина Кобм находится в пределах 10-1 – 10-15.
В кислых растворах аН+ > КобмаМе+ и уравнение имеет вид
jст = j0ст + в0lgaH+ = j0ст – рН.
В таких растворах потенциал стеклянного электрода зависит только от активных водородных ионов и может служить индикаторным электродом при определении рН и кислотно-щелочном титровании.
Когда аН+< КобмаМе+, то есть в щелочной среде уравнение также упрощается:
jст = j0ст + в0lgaMe+,
где в величину j0ст входит в0lgK.
Если источником катионов служит раствор щелочи, то аМе+ = аОН-, а так как
аН+×аОН- = к, то для щелочных растворов получим уравнение
jст = j0ст + в0рН.
ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Под термином потенциометрическое титрование объединяют методы определения конечной точки на основе зависимости потенциал - объем добавленного титранта в исследуемую среду.
В зависимости от типа реакции методы потенциометрического титрования делятся на методы осаждения, нейтрализации, комплексообразования и окислительно-восстановительные методы.
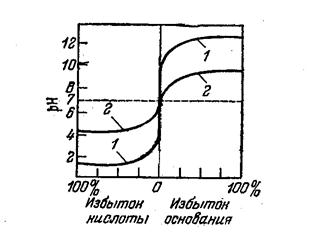
На рисунке приведены кривые титрования метода нейтрализации в зависимости от силы кислот и оснований.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1131; Нарушение авторских прав?; Мы поможем в написании вашей работы!