
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория активных столкновений молекул
|
|
|
|
Совокупность стадий, из которых складывается химическая реакция, называется ее механизмом. Молекулярно-кинетическая теория позволяет на основе данных о массе, форме и размерах молекул, энергетической характеристики отдельных связей атомов или атомных групп в молекуле, а также с учетом совокупности энергетических состояний молекулы и внешних условий вычислить скорость процесса. В химической кинетике постулируется, что для осуществления элементарной реакции взаимодействующие молекулы, атомы, радикалы или ионы должны столкнуться. При этом следует учитывать, что молекулы взаимодействуют не только в момент их столкновения в элементарном акте, но проявляется дальнодействие молекул и тогда, когда они не сталкиваются.
В понятие «столкновение» в химической кинетике вкладывается следующий смысл. Молекулы реального газа взаимодействуют друг с другом сложным образом. При малом расстоянии друг от друга они отталкиваются, на большом расстоянии притягиваются. Если диаметр молекулы s, то две одинаковые молекулы придут в соприкосновение тогда, когда расстояние между их центрами станет равным s. Отсюда двигающаяся молекула сталкивается со всеми молекулами, центры которых окажутся на расстоянии s от ее центра. Величина ps2 называется эффективным сечением столкновения. Она равна площади сечения окружающей молекулу воображаемой сферы, в которую не может проникнуть центр другой молекулы. Когда молекулы отталкиваются, то, начиная с некоторого расстояния между ними, путь искривляется и молекулы начнут расходиться.
Когда взаимодействуют молекулы разного диаметра, тогда эффективный диаметр столкновения равен полусумме диаметров сталкивающихся молекул. Применение молекулярно-кинетической теории для расчета скорости химических реакций основано на предположении, что каждое столкновение вызывает элементарный акт взаимодействия. Отсюда следует: скорость химической реакции может быть найдена, исходя из данных о числе столкновений между молекулами. Число столкновений между молекулами Z одного сорта можно подсчитать по формуле
|
|
|
Z = 2n2s2(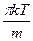 )1/2 = 2n2s2(
)1/2 = 2n2s2(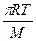 )1/2,
)1/2,
где n — число молекул в 1 см3; М — молекулярный вес.
Сравнение скорости, рассчитанной по формуле, с найденной опытным путем показало, что последняя значительно меньше. Это говорит о том, что лишь небольшое число столкновений между молекулами приводит к реализации элементарного акта.
Расхождение между числом столкновений и числом реагирующих молекул, а также найденная в опыте зависимость скорости реакции от температуры позволили Аррениусу высказать гипотезу о том, что вступать в реакцию способны только те молекулы, энергия которых превышает некоторую критическую величину Е. Ранее было отмечено, что эта критическая величина есть энергия активации.
Молекулярно-кинетическая теория для числа столкновений молекул, энергия которых превышает некоторую критическую величину Е, дает уравнение
Za = Z0e-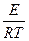 ,
,
где Za — число активных столкновений молекул; Z0 — общее число столкновений в секунду.
Таким образом, реакция возникает только тогда, когда энергия сталкивающихся молекул превышает некоторую критическую величину — энергию активации Е. Ее величину находят из экспериментальной зависимости константы скорости реакции от температуры или по данным о числе активных столкновений.
Для сложных молекул при их активном соударении активные группы должны принимать такую геометрическую конфигурацию, которая обеспечивала бы образование продуктов реакции. В связи с этим в уравнение для скорости реакции вводится стерический множитель Р. Введение его в уравнение указывает на то, что химическая реакция при активном столкновении не абсолютно достоверна, а имеет конечную вероятность, равную Р.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 652; Нарушение авторских прав?; Мы поможем в написании вашей работы!