
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение окислительно-восстановительных условий пресной воды открытых водоемов
|
|
|
|
Абсолютную величину окислительно-восстановительного потенциала определить невозможно, поэтому его измеряют относительно стандартного, чаще всего водородного, нормальный потенциал которого принят равным 0 в реакции
 .
.
Существуют таблицы нормативных окислительно-восстановительных потенциалов, которые определены при концентрации их солевых растворов с концентрацией 1 моль/л и при t=200С.
Пользуясь нормальными окислительно-восстановительными потенциалами, можно определить вещество в реакции будет окислителем или восстановителем, в каком направлении пойдет реакция, рассчитать окислительно-восстановительный потенциал данного процесса.
Пример:

 Е0=1,36 В – окислитель
Е0=1,36 В – окислитель
 Е0=0,14 В
Е0=0,14 В
Еh= 1,36 – 0,14 = 1,22 В
Еh> 0 – самопроизвольное протекание реакции.
Зависимость величины окислительно-восстановительного потенциала от концентрации окисленной и восстановленной формы в растворе описывается формулой Нернста:
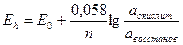
а – активность соединения в окисленной и восстановленной форме;
n – число электронов, отданных инертному электроду, при протекании окислительно-восстановительной реакции.
Для тех реакций, где одним из компонентов является вода или ионы Н+ окислительная способность зависит от рН

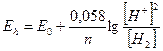
n = 2
Е0 = 0 для водородного электрода

Обозначим - lg [H2] = rH2
lg [H2] – отрицательный логарифм давления молекулярного водорода, тогда
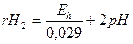
Уравнение позволяет охарактеризовать окислительно-восстановительные свойства среды: чем меньше rH2, тем легче идут процессы восстановления.
Нейтральным относительно окислительно-восстановительных условий для водных растворов принимается значение rH2 = 28, при rH2 > 28 – в водоеме окисление, при rH2 < 28 – восстановление.
Еh = f ([Н2], [Н+]) – характеристика свободной энергии окислительно-восстановительной системы.
С помощью Еh можно охарактеризовать окислительно-восстановительные условия системы только при рН = const.
rH2 – зависит только от концентрации восстановителя, поэтому rH2 полностью характеризует окислительно-восстановительные условия системы.
Об окислительно-восстановительных условиях пресной воды в открытых водоемах можно судить по величине окислительно-восстановительного показателя
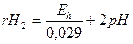
рН, Еh – могут быть определены экспериментально.
Растворенный в воде кислород является окислителем, реакция в ионном виде может быть представлена

Если Еh нельзя определить экспериментально, то он может быть рассчитан по уравнению:

Е0 – нормальный электродный потенциал О2, является функцией рН, может быть определен по графику
Е0 = 1,234 при рН = 0 – кислая среда
Е0 = 0,825 при рН = 7
Е0 = 0,407 при рН = 14




 1,234 Е0
1,234 Е0
 |





 0,825
0,825
 0,407
0,407
 |


0 7 14 рН
Окислительные свойства кислород проявляет только в кислой среде!
Задача №1
Дано: рН = 7,8; Кнас = 90%; Е0 = 0,779 В
t = 250 С; растворимость О2 = 8,28 мгО2/л
Найти: Еh -? rH2 -?
Решение



Ответ: в водоеме восстановление.
Задача №2
Дано: рН = 6,6; К= 90%; Е0 = 0,840 В
t = 250 С; растворимость О2 = 8,28 мгО2/л
Найти: Еh -? rH2 -?
Решение

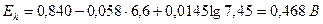
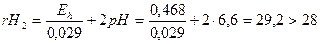
Ответ: в водоеме окисление.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 724; Нарушение авторских прав?; Мы поможем в написании вашей работы!